工艺流程图题目讲课教案Word下载.docx
《工艺流程图题目讲课教案Word下载.docx》由会员分享,可在线阅读,更多相关《工艺流程图题目讲课教案Word下载.docx(14页珍藏版)》请在冰豆网上搜索。
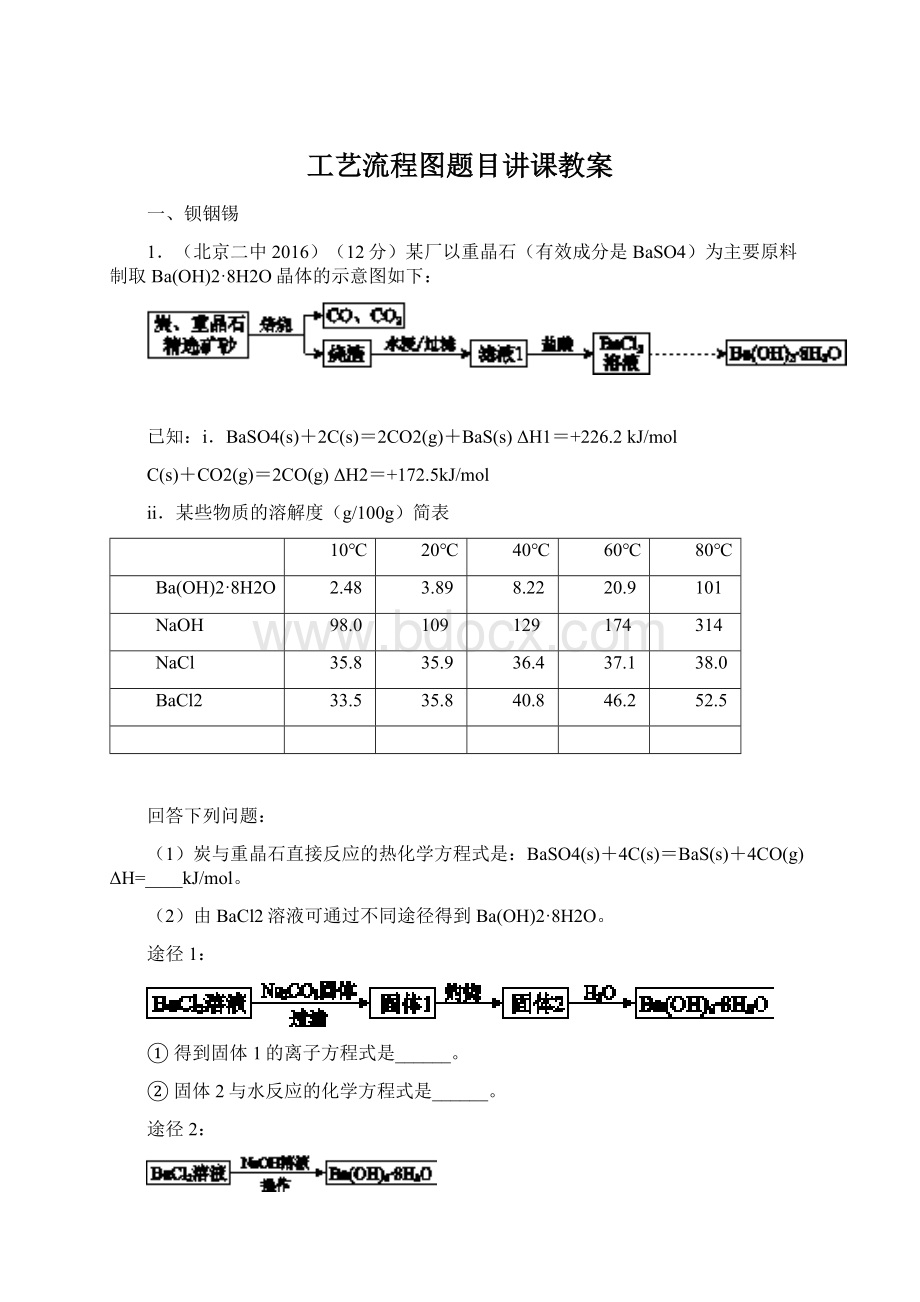
129
174
314
NaCl
35.8
35.9
36.4
37.1
38.0
BaCl2
33.5
40.8
46.2
52.5
回答下列问题:
(1)炭与重晶石直接反应的热化学方程式是:
BaSO4(s)+4C(s)=BaS(s)+4CO(g)ΔH=____kJ/mol。
(2)由BaCl2溶液可通过不同途径得到Ba(OH)2·
8H2O。
途径1:
①得到固体1的离子方程式是______。
②固体2与水反应的化学方程式是______。
途径2:
途径2中的“操作”是加热浓缩,冷却结晶,过滤。
依据上述溶解度简表分析,过滤时的最佳温度是;
(3)若向滤液1中加入CuO粉末,可直接得到含Ba(OH)2·
8H2O晶体和CuS的浊液,反应化学方程式是______。
将该浊液加热到80℃左右浓缩,趁热过滤,冷却滤液至室温,再过滤,即可得到Ba(OH)2·
8H2O晶体。
上述操作
中趁热过滤的原因是______。
2.(2018东城期末)(10分)从废旧液晶显示器的主材ITO(主要成分是含铟、锡的氧化物)回收铟和锡,流程示意图如下。
资料:
物质
铟(In)
锡(Sn)
周期表位置
第五周期、第IIIA族
第五周期、第IVA族
颜色、状态
银白色固体
与冷酸作用
缓慢反应
与强碱溶液
不反应
反应
(1)为了加快步骤①的反应速率,可以采取的措施有______(至少答两点)。
(2)步骤①中铟的氧化物转化成In3+的离子方程式是______。
(3)步骤②中加入过量铟能够除去溶液中的Sn2+,根据所给资料分析其原因是______。
(4)步骤④和⑤中NaOH溶液的作用是______。
(5)下图是模拟精炼铟的装置图,请在方框中填写相应的物质。
1、
(1)+571.2;
(2)CO32-+Ba2+=BaCO3↓;
BaO+9H2O=Ba(OH)2•8H2O;
20℃或常温;
20℃时4种物质中Ba(OH)2•8H2O溶解度最小;
(3)BaS+CuO+9H2O=Ba(OH)2•8H2O+CuS;
减少过滤过程中Ba(OH)2•8H2O的损失.
2.(2018东城期末)(10分)
(1)增大盐酸浓度、加热、将废料粉碎
(2)In2O3+6H+==2In3++3H2O
(3)同周期主族元素从左向右原子半径减小,金属性减弱(还原性减弱)
(4)除去a、b两种滤渣中的锡和锌
(5)
二、铬
1.(人大附2015)(10分)
某厂废水中含5.00×
10-3
mol·
L-1的Cr2O72-,其毒性较大。
某研究性学习小组为了变废为宝,将废水处理得到磁性材料Cr0.5Fe1.5FeO4(Fe的化合价依次为+3、+2),设计了如下实验流程
(1)第①步反应的离子方程式是________________。
(2)第②步中用PH试纸测定溶液PH的操作是:
________________。
(3)第②步过滤得到的滤渣中主要成分除Cr(OH)3外,还有________________。
(4)欲使1L该废水中的Cr2O72-完全转化为Cr0.5Fe1.5FeO4。
理论上需要加入________________g
FeSO4·
7H2O。
2.(2017东城期末)(12分)利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用。
其工作流程如下:
(1)铝热法冶炼金属铬,是利用了金属铝的(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、。
(3)过程Ⅰ,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。
冶炼Al的化学方程式是。
②滤渣B受热分解所得物质可以循环利用,B是。
③已知:
2CrO42-+2H+Cr2O72-+H2OK=4.0×
1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是mol/L。
(5)过程Ⅱ的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称
0°
C
20°
40°
60°
80°
35.7
36.0
36.6
37.3
38.4
KCl
28.0
34.2
40.1
45.8
51.3
K2SO4
7.4
11.1
14.8
18.2
21.4
K2Cr2O7
4.7
12.3
26.3
45.6
73.0
Na2Cr2O7
163
183
215
269
376
结合表中数据分析,过程Ⅱ得到K2Cr2O7粗品的操作是:
,
过滤得到K2Cr2O7粗品。
1、
(1)Cr2O72-+6Fe2++14H+==2Cr3++6Fe3++7H2O
(2)将一小块pH试纸放在表面皿上,用玻璃棒蘸取少量待测液,点在pH试纸上,再与标准比色卡对照。
(3)Fe(OH)3、Fe(OH)2
(4)13.9
2.(2017东城期末)(12分)
(1)还原性
(2)AlO2-、OH-(3)0.3mol
(4)①2Al2O3(熔融)3O2↑+4Al②NaHCO3③0.01
(5)向滤液③中加入稀盐酸和KCl固体后,蒸发浓缩、降温结晶
三、钛
1、(2017西城重点中学)工业上,以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。
钛铁矿主要成分为钛酸亚铁(TeTiO3),其中一部分铁盐酸在风化过程中会转化为+3价。
TiOSO4遇水会分解
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的反应的离子方程式为______________。
(2)步骤③中,实现混合物的分离是利用物质的______(填字母序号)
a.熔沸点差异b.溶解性差异c.氧化性、还原性差异
(3)步骤②、③、④中,均需用到的操作是_________(填操作名称)
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:
_______。
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为_________________。
(6)研究发现,可以用石墨作阳极、铁网作阴极、熔触CaF2-CaO作电解质,利用下图所示装置获得金属钙,并以钙为还原剂,还原二氧化钛制备金属钛。
①写出阳极所发生反应的电极反应式:
______________。
②在制备金属钛前后,CaO的总量不变,其原因是(请结合化学用语解释)______________。
2.(12分)钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:
(1)钛铁矿在预处理时需要进行粉碎,其原因是___________________。
(2)过程①中反应的离子方程式是:
FeTiO3+4H++4Cl-==Fe2++TiOCl42-+2H2O、_______。
(3)过程①中,铁的浸出率结果如图1所示。
由图可知,当铁的浸出率为80%时,所采用的实验条件是___________________。
(4)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图2所示,反应温度过高时,Ti元素浸出率下降的原因是___________。
(5)在滤液B转化为FePO4沉淀过程中发生以下反应,请配平:
(6)过程中由FePO4制备LiFePO4的化学方程式是_________________________。
3.(13分)用钒钛磁铁矿为原料冶炼铁,产生一种固体废料,主要成分如下表。
通过下列工艺流程可以实现元素Ti、Al、Si的回收利用,并得到纳米二氧化钛和分子筛。
请回答下列问题:
(1)步骤①②③中进行分离操作的名称是,
(2)下列固体废料的成分中,不属于碱性氧化物的是(填字母序号)。
a.TiO2b.MgOc.SiO2d.CaO
(3)熔融温度和钛的提取率关系如下图,适宜温度为500℃,理由是。
(4)滤液①中溶质的成分是。
(5)步骤②中发生反应的离子方程式是。
(6)将步骤③中制取分子筛的化学方程式补充完整:
根据成分表中数据,计算10kg固体废料,理论上应再加入Na2Si03物质的量的计算式是n(Na2SiO3)=mol(摩尔质量/g/mol:
SiO260Al2O3102)。
1、(2017西城重点中学)(15分)
(1)2Fe3++Fe=3Fe2+;
(2)b
(3)过滤
(4)溶液中存在平衡:
TiO2++2H2OH2TiO3+2H+,当加入热水稀释、升温后,平衡正向移动,生成H2TiO3。
(3分)
(说明:
写出离子方程式或化学方程式得l分,从稀释和升温角度正确分析平衡移动各得l分。
)
(5)MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
(6)①2O2--4e-=O2↑(同时写出C+O2=CO2不扣分)或C+2O2--4e-=CO2↑
②制备TiO2时,在电解槽发生如下反应:
2CaO2Ca+O2↑,2Ca+TiO2Ti+2CaO
由此可见,CaO的量不变。
(两个方程式各1分,不写“一定条件”不扣分)
或:
制备TiO2时,在电解槽发生如下反应:
阴极:
2Ca2++4e-=2Ca,阳极:
2O2--4e-=O2↑,2Ca+TiO2Ti+2CaO
(电极反应式和化学方程式各1分,不写“一定条件”不扣分)。
2.(12分)
(1)增大反应物接触面积,加快反应速率。
(2)MgO+2H+====Mg2++H2O
(3)100℃3小时
(4)温度过高,双氧水分解与氨气逸出导致Ti元素浸出率下降
高温
(5)2Fe2++H2O2+2H3PO4==2FePO4+4H++2H2O
(6)2FePO4+Li2CO3+H2C2O4====2LiFePO4+3CO2↑+H2O
3、
四、碳和硅
1.(2016北大附中)(16分)石墨在材料领域有重要应用。
某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)
和MgO(0.5%)等杂质。
设计的提纯和综合应用工艺如下:
(注:
SiCl4的沸点是57.6º
C,金属氯化物的沸点均高于150º
C)
(1)Si的原子结构示意图是。
(2)下列说法正确的是。
a.酸性:
H2CO3>
H2SiO3b.原子半径:
O<
Si
c