探究型综合实验题Word下载.docx
《探究型综合实验题Word下载.docx》由会员分享,可在线阅读,更多相关《探究型综合实验题Word下载.docx(12页珍藏版)》请在冰豆网上搜索。
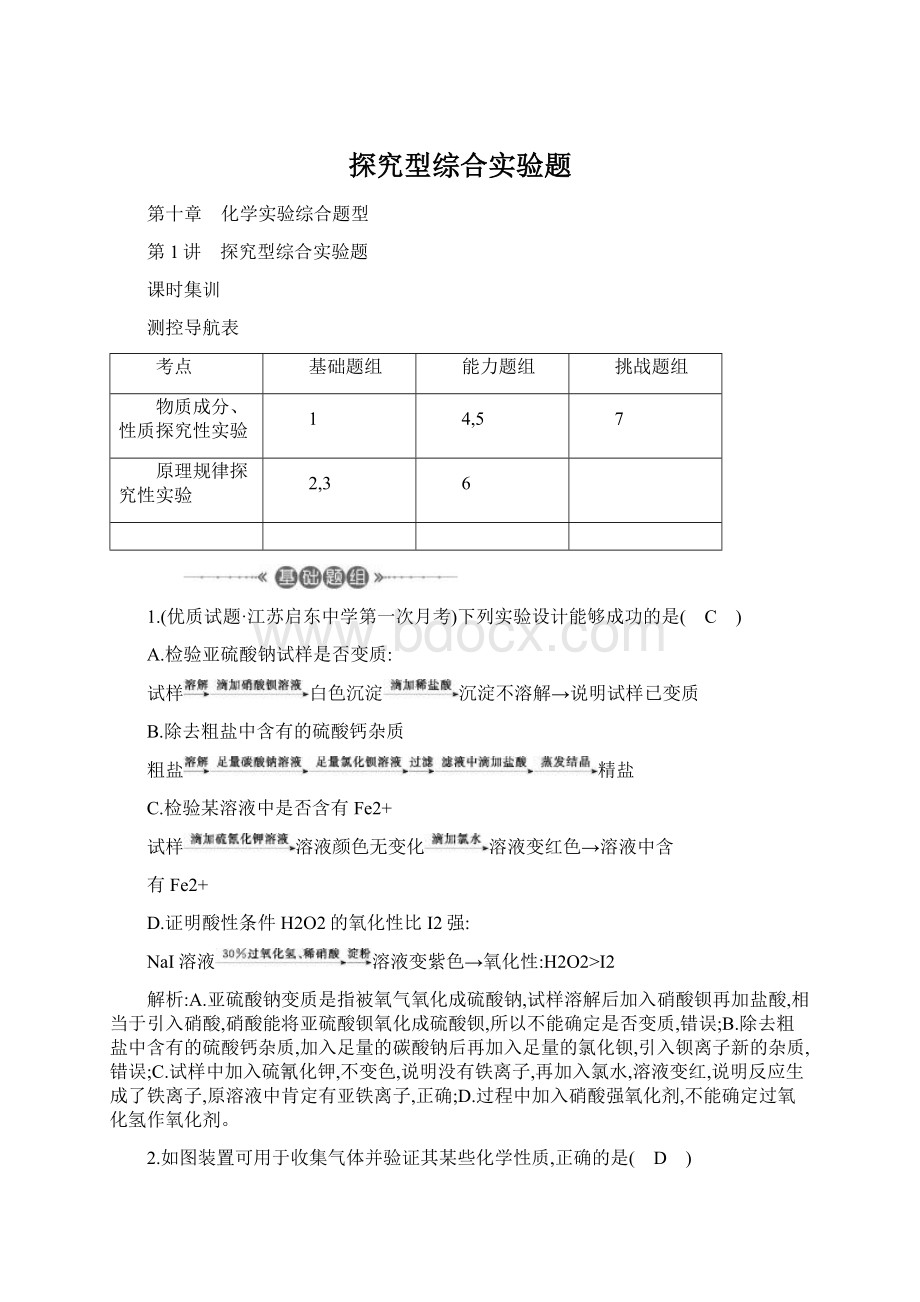
C.检验某溶液中是否含有Fe2+
试样溶液颜色无变化溶液变红色→溶液中含
有Fe2+
D.证明酸性条件H2O2的氧化性比I2强:
NaI溶液溶液变紫色→氧化性:
H2O2>
I2
解析:
A.亚硫酸钠变质是指被氧气氧化成硫酸钠,试样溶解后加入硝酸钡再加盐酸,相当于引入硝酸,硝酸能将亚硫酸钡氧化成硫酸钡,所以不能确定是否变质,错误;
B.除去粗盐中含有的硫酸钙杂质,加入足量的碳酸钠后再加入足量的氯化钡,引入钡离子新的杂质,错误;
C.试样中加入硫氰化钾,不变色,说明没有铁离子,再加入氯水,溶液变红,说明反应生成了铁离子,原溶液中肯定有亚铁离子,正确;
D.过程中加入硝酸强氧化剂,不能确定过氧化氢作氧化剂。
2.如图装置可用于收集气体并验证其某些化学性质,正确的是( D )
选项
气体
试剂
现象
结论
A
NH3
酚酞试液
溶液变红色
NH3的水
溶液显碱性
B
Cl2
紫色石蕊试液
溶液先变
红后褪色
Cl2有酸性
和漂白性
C
SO2
溴水
溶液褪色
SO2气体
具有漂白性
D
X
淀粉KI溶液
溶液变蓝
X可能是
Cl2或NO2
A项,氨气的密度比空气小,应“短进长出”;
B项中,Cl2没有酸性和漂白性;
C项,体现SO2的还原性;
D项,Cl2和NO2均能将I-氧化
成I2。
3.(优质试题·
江苏南京三模)下列设计的实验方案能达到实验目的的是( C )
A.向1mL1%的NaOH溶液中加入2mL2%的CuSO4溶液,振荡后再加入0.5mL有机物X,加热后未出现红色沉淀,说明X结构中不含有醛基
B.室温下向苯和少量苯酚的混合溶液中加入适量浓溴水,振荡、静置后过滤,可除去苯中少量苯酚
C.向无色的淀粉KI溶液中滴加少量氯水,溶液变成蓝色,说明氧化性:
Cl2>
D.向含酚酞的氢氧化钠溶液中加入少量30%H2O2溶液,红色褪去,向褪色后的溶液再补加NaOH溶液,不显红色,说明H2O2因显酸性而使溶液褪色
用新制的氢氧化铜检验醛基时,必须是在碱性条件下,该实验中NaOH不足导致NaOH和硫酸铜混合溶液不是碱性,所以实验不成功,A错误;
苯酚和溴发生取代反应生成2,4,6三溴苯酚,与苯能互溶,应该用NaOH和苯酚反应生成可溶性的苯酚钠,然后分液除去苯中的苯酚,
B错误;
同一氧化还原反应中氧化剂的氧化性大于氧化产物的氧化性,根据实验现象知,氯气氧化碘离子生成碘,氧化剂是氯气、碘是氧化产物,则氧化性:
I2,C正确;
因为该反应中双氧水的量较少,混合溶液中NaOH过量,混合溶液呈碱性,但溶液褪色,说明酚酞发生了反应,该实验应该体现双氧水的氧化性,D错误。
4.导学号16972227某课外小组制备SO2并探究SO2的相关性质,他们设计了如图1装置(夹持仪器省略):
称量样品w克溶液
图2
图3
(1)实验需要大约100mL的1∶1硫酸(浓硫酸与溶剂水的体积比),配制该硫酸时需要的玻璃仪器是玻璃棒、 、 ,配制过程为
。
(2)图1中装置A的作用是 。
(3)若需要对比干燥SO2和湿润的SO2的漂白性,则各仪器中需要加入的试剂分别是:
C:
D:
E:
品红溶液 F:
NaOH溶液
若需要先后验证SO2的氧化性与还原性,则各仪器中需要加入的试剂分别是:
空瓶 D:
E:
F:
写出验证SO2还原性装置中的离子反应方程式:
(4)亚硫酸钠易被氧化,在图3方框内设计一个实验流程图测定亚硫酸钠的质量分数,设样品质量为w克,流程图样例如图2,需要测定的数据自行设定符号表示,列出亚硫酸钠质量分数的计算表达式,并说明各符号的意义:
(1)配制大约100mL的1∶1硫酸时需要的玻璃仪器为玻璃棒、烧杯、量筒;
配制过程为将50mL浓硫酸沿玻璃棒缓缓加入盛有50mL水的烧杯中,边加边搅拌。
(2)图1中装置A的作用是保证上下压强相同,确保液体顺利流下。
(3)若需要对比干燥SO2和湿润的SO2的漂白性,则首先应对二氧化硫进行干燥,则先通过浓硫酸,再通过干燥的品红试纸,检验干燥SO2的漂白性,最后通过品红溶液检验湿润的SO2的漂白性;
若需要先后验证SO2的氧化性与还原性,氧化性则通过还原剂Na2S溶液看是否有S沉淀生成验证;
还原性则通过看氧化剂溴水是否褪色验证,离子方程式为SO2+Br2+2H2OS+2Br-+4H+。
(4)因为亚硫酸钠易被氧化成硫酸钠,硫酸钡不溶于盐酸而亚硫酸钡溶于盐酸,所以流程为称取样品质量为w克溶液固体固体a克,则亚硫酸钠质量分数=(1-)×
100%(硫酸钡质量为a克,样品质量为w克)。
答案:
(1)烧杯 量筒 将50mL浓硫酸沿玻璃棒缓缓加入盛有50mL水的烧杯中,边加边搅拌
(2)确保液体顺利流下
(3)浓硫酸 干燥的品红试纸 Na2S溶液 溴水
SO2+Br2+2H2OS+2Br-+4H+
(4)称取样品质量为w克溶液固体固体a克 亚硫酸钠质量分数=(1-)×
100%(硫酸钡质量为a克,样品质量为w克)
5.(优质试题·
安徽太和中学月考)新型纳米材料αFe粉末具有超强磁性,可用作高密度磁记录的介质和高效催化剂等。
某校化学小组学生利用如图所示装置进行探究实验,已知该校实验室的酒精灯火焰温度约为500℃。
【查阅资料】
在不同温度下,αFe粉末与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO,高于570℃时,生成Fe3O4。
【探究一】
(1)甲同学用左图装置进行αFe粉末与水蒸气的反应,湿棉花的作用是 ;
写出该反应的化学方程式:
。
【探究二】
乙同学用右图装置进行αFe粉末与水蒸气反应并验证产物。
步骤
实验操作
实验现象
Ⅰ
取少量反应后的黑色粉末X,加入少量盐酸,微热
黑色粉末逐渐溶解,溶液呈浅绿色,产生少量气泡
Ⅱ
向实验Ⅰ得到的溶液中滴加2滴KSCN溶液,振荡
溶液没有出现红色
(2)实验前必须对整套装置进行的操作是 ;
试管a中的物质是 。
(3)水槽中的试管里收集的气体是 ;
如果要点燃该气体,必须进行的操作是 。
(4)实验现象不能确定是否存在Fe3O4的主要原因是 (用离子方程式表示)。
【探究反思】
(5)乙同学称取5.60gFe粉,用右图装置反应一段时间后,停止加热,在干燥器中冷却后,称得质量为6.88g,取冷却后的固体与足量FeCl3溶液充分反应,测定消耗FeCl3的物质的量,最终确定产物的成分。
若此装置中Fe粉与水蒸气反应的产物为Fe3O4,则消耗FeCl3的物质的量应为 mol。
(1)加热试管使湿棉花中的水蒸发,湿棉花主要是提供反应物水蒸气,与αFe粉末发生反应:
Fe+H2O(g)FeO+H2。
(2)反应生成氢气,所以实验前必须检查装置气密性;
试管a中的物质是水。
(3)收集的气体是H2;
为了防止爆炸,点燃气体前,必须对气体进行
验纯。
(4)步骤Ⅰ只能说明生成亚铁离子,步骤Ⅱ说明溶液中没有铁离子,也有可能是生成了铁离子,但因为铁粉过量,与铁离子反应生成了亚铁离子,所以不能确定是否存在Fe3O4,Fe+2Fe3+3Fe2+。
(5)增加的质量就是氧元素的质量,即n(O)==0.08mol,根据关系式Fe3O4~4O~3Fe计算,消耗0.06mol铁,即剩余0.04mol铁与氯化铁反应,消耗0.08mol氯化铁。
(1)提供水蒸气作反应物 Fe+H2O(g)FeO+H2
(2)检查气密性 水 (3)氢气 验纯
(4)Fe+2Fe3+3Fe2+或Fe+Fe3O4+8H+4Fe2++4H2O (5)0.08
6.(优质试题·
安徽卷,28)某研究小组为探究弱酸性条件下铁发生电化学腐蚀类型的影响因素,将混合均匀的新制铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图1)。
从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
(1)请完成以下实验设计表(表中不要留空格):
编号
实验目的
碳粉/g
铁粉/g
醋酸/%
①
为以下实验作参照
0.5
2.0
90.0
②
醋酸浓度的影响
36.0
③
0.2
(2)编号①实验测得容器中压强随时间变化如图2。
t2时,容器中压强明显小于起始压强,其原因是铁发生了 腐蚀,请在图3中用箭头标出发生该腐蚀时电子流动方向;
此时,碳粉表面发生了 (填“氧化”或“还原”)反应,其电极反应式是 。
(3)该小组对图2中0~t1时压强变大的原因提出了如下假设,请你完成假设二:
假设一:
发生析氢腐蚀产生了气体;
假设二:
;
……
(4)为验证假设一,某同学设计了检验收集的气体中是否含有H2的方案。
请你再设计一个实验方案验证假设一,写出实验步骤和结论。
实验步骤和结论(不要求写具体操作过程):
(1)对比实验①,实验②中碳粉的质量与实验①相同,醋酸的浓度与实验①不同,所以铁粉的质量应与实验①相同,即2.0g;
实验③中碳粉质量与实验①不同,铁粉质量和醋酸浓度均与实验①相同,显然实验③目的是探究碳粉含量的影响。
(2)t2时,容器中压强明显小于起始压强,说明容器中气体减少,所以铁发生的是吸氧腐蚀。
在铁吸氧腐蚀过程中,铁为负极,发生氧化反应,形成Fe2+,碳为正极,发生还原反应:
2H2O+O2+4e-4OH-(或4H++O2+4e-2H2O)。
(3)0~t1时压强增大,应从两方面考虑,一是生成气体,二是温度升高,则由假设一内容可得假设二应是:
此反应是放热反应,温度升高。
(4)可通过测定压强验证假设一,设计实验时要注意以下3点:
一是实验条件与实验①相同,二是排除O2的干扰,三是温度不变。
(1)2.0 碳粉含量的影响
(2)吸氧 还原
2H2O+O2+4e-4OH-(或4H++O2+4e-2H2O)
(3)反应放热,温度升高
(4)①药品用量和操作同编号①实验(多孔橡皮塞增加进、出导管);
②通入氩气排净瓶内空气;
③滴入醋酸溶液,保持温度不变,测量瓶内压强变化。
如果瓶内压强增大,假设一成立。
否则假设一不成立。
(本题属于开放性试题,也可检验Fe2+)
7.导学号16972228以Na2SO3溶液和不同金属的硫酸盐溶液作为实验对象,探究盐的性质和盐溶液间反应的多样性。
实验
滴管
试管
0.2mol·
L-1
Na2SO3
溶液
饱和Ag2SO4溶液
Ⅰ.产生白色沉淀
CuSO4溶液
Ⅱ.溶液变绿,继续滴加产生棕黄色沉淀
0.1mol·
Al2(SO4)3溶液
Ⅲ.开始无明显变化,继续滴加产生白色沉淀
(1)经检验,现象Ⅰ中的白色沉淀是Ag2SO3。
用离子方程式解释现象Ⅰ:
(2)经检验,现象Ⅱ的棕黄色沉淀中不含S,含有Cu+、Cu2+和S。
已知:
Cu+Cu+Cu2+,Cu