解析江西省南昌市新建县第一中学学年高二上学期期中考试化学试题Word文档下载推荐.docx
《解析江西省南昌市新建县第一中学学年高二上学期期中考试化学试题Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《解析江西省南昌市新建县第一中学学年高二上学期期中考试化学试题Word文档下载推荐.docx(21页珍藏版)》请在冰豆网上搜索。
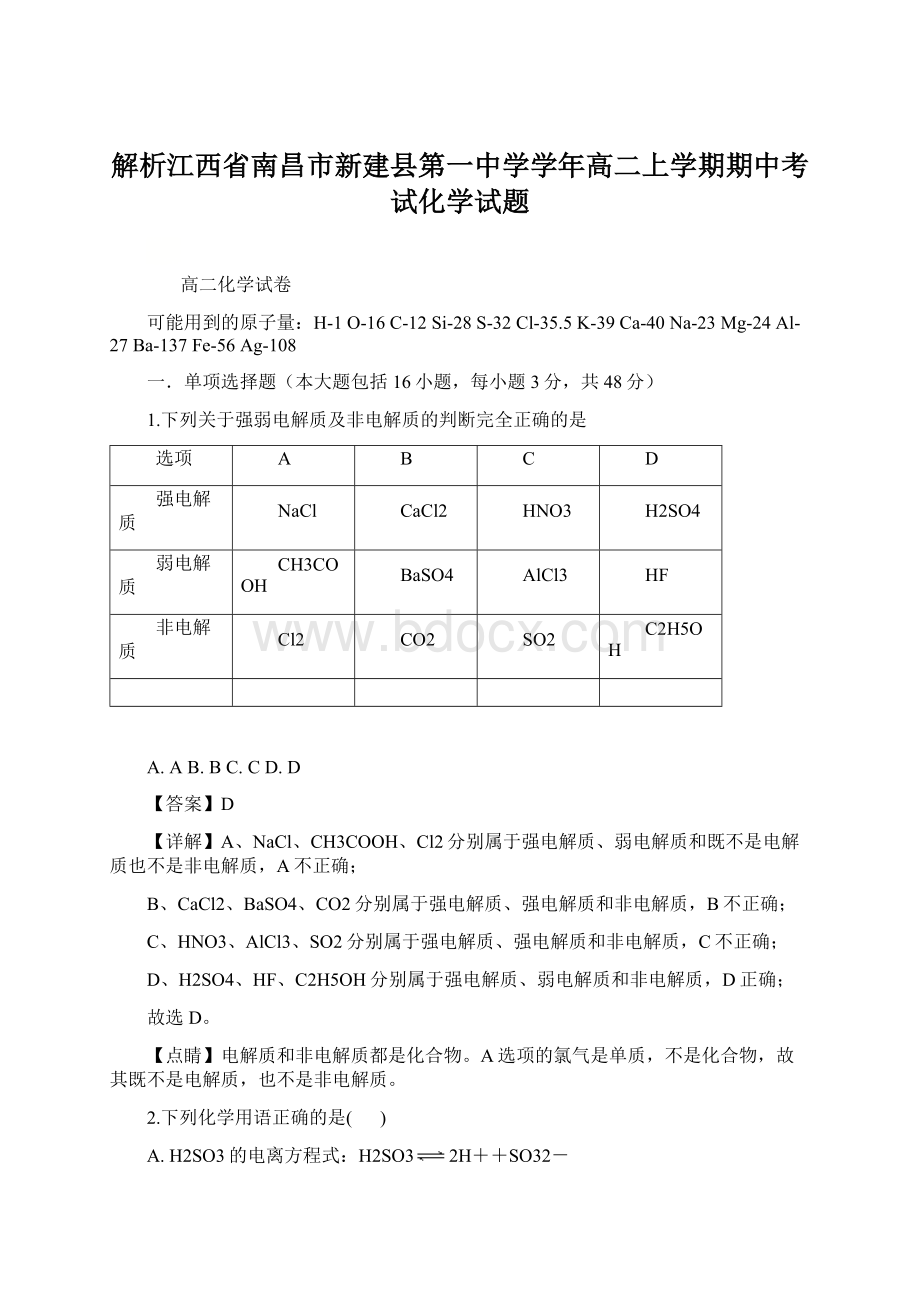
BaSO4
AlCl3
HF
非电解质
Cl2
CO2
SO2
C2H5OH
A.AB.BC.CD.D
【答案】D
【详解】A、NaCl、CH3COOH、Cl2分别属于强电解质、弱电解质和既不是电解质也不是非电解质,A不正确;
B、CaCl2、BaSO4、CO2分别属于强电解质、强电解质和非电解质,B不正确;
C、HNO3、AlCl3、SO2分别属于强电解质、强电解质和非电解质,C不正确;
D、H2SO4、HF、C2H5OH分别属于强电解质、弱电解质和非电解质,D正确;
故选D。
【点睛】电解质和非电解质都是化合物。
A选项的氯气是单质,不是化合物,故其既不是电解质,也不是非电解质。
2.下列化学用语正确的是(
)
A.H2SO3的电离方程式:
H2SO32H++SO32-
B.NaHSO4在水溶液中的电离方程式:
NaHSO4=Na++H++SO42-
C.Na2CO3的水解∶CO32-+2H2OH2CO3+2OH-
D.NH4Cl的水解:
NH4++H2O=NH3·
H2O+H+
【答案】B
【分析】
本题考查的基本化学用语的使用,掌握电离方程式,水解方程式的正确表达方式。
【详解】A.H2SO3的电离分步进行,电离方程式写出第一步电离即可,正确的电离方程式为:
H2SO3H++HSO3-,A项错误;
B.NaHSO4在水溶液中完全电离,其电离方程式为:
NaHSO4=Na++H++SO42-,B项正确;
C.CO32-的水解分步进行,主要以第一步为主,碳酸根离子正确的水解方程式为:
CO32-+H2OHCO3-+OH-,C项错误;
D.NH4Cl中的NH4+的水解是微弱的,应用,其水解方程为:
NH4++H2ONH3·
H2O+H+,D项错误;
答案选B。
【点睛】书写电离方程关键是判断电解质的电离程度,从而选择正确的连接方式。
特别注意多元弱酸是分步电离,以第一步为主;
多元弱酸根是分步水解,以第一步水解为主。
3.下列说法正确的是()
A.所有自发进行的化学反应都是放热反应
B.铁在潮湿空气中生锈是自发过程
C.在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向
D.298K时,2H2S(g)+SO2(g)═3S(s)+2H2O(l)能自发进行,则其ΔH>
【详解】A、能自发进行的化学反应不一定是放热反应。
自发进行的条件为△G=△H-T△S<
0即可,与吸热反应或放热反应无关,A不正确;
B、铁在潮湿空气中生锈是原电池原理,形成原电池的条件为自发的氧化还原反应,B正确;
C、催化剂只改变反应速率,不能使化学平衡移动,C不正确;
D、由2H2S(g)+SO2(g)═3S(s)+2H2O(l)可知为熵减小的反应,即△S<
0,要使反应能自发进行,则△G=△H-T△S<
0,则其ΔH<
0,D不正确;
故选B。
【点睛】反应是否自发进行与吸热反应或放热反应无关,有的放热反应能自发进行,有的吸热反应也能自发进行,如八水合氢氧化钡与氯化铵反应为吸热反应,但能自发进行。
0。
4.下列事实能用勒夏特列原理解释的是
A.红棕色的NO2,加压后颜色变深
B.对于反应2HI(g)
H2(g)+I2(g),达到平衡后,缩小容器的体积可使体系颜色变深
C.实验室中常用排饱和食盐水的方法收集氯气
D.500℃左右比室温更利于合成氨反应
【答案】C
平衡移动原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,平衡移动原理适用的对象应存在可逆过程,如与可逆过程无关,则不能用平衡移动原理解释,以此解答该题。
【详解】A、存在平衡2NO2(g)=N2O4(g),增大压强,混合气体中各组分的浓度均增大,气体的颜色变深,所以不可以用平衡移动原理解释,故A不选;
B、反应前后气体的分子数不变,增加压强平衡不移动,混合气体的浓度增大,平衡体系颜色变深,不能利用勒夏特列原理解释,故B不选;
C、实验室可用排饱和食盐水的方法收集氯气,氯气和水的反应是可逆反应,饱和氯化钠溶液中氯离子浓度大,化学平衡逆向进行,减小氯气溶解度,能用勒夏特列原理解释,故选C;
D、合成氨反应为放热反应,升高温度,不利于平衡向正向移动,但温度过低,反应速率较低,不利于工业生产,主要考虑催化剂的活性,不能用勒夏特列原理解释,故D不选;
故选C。
5.常温下,下列各组离子在指定的条件下能大量共存的是(
)
A.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
B.四种离子Na+、Ca2+、AlO2-、HCO3-不能大量共存的原因是AlO2-和HCO3-发生双水解
C.由水电离出的c(H+)=10-12
mol·
L-1的溶液中:
Mg2+、Na+、SO42-、ClO-
D.通入足量CO2的溶液中:
Na+、Cl-、K+、SO42-
【详解】A、中性溶液中不能大量存在Fe3+,A不符合;
B、AlO2-、HCO3-不发生双水解,B不符合;
C、由水电离出的c(H+)=10-12mol·
L-1的溶液可能是酸性的,也可能是碱性的,当溶液为碱性时,不能大量存在Mg2+,当溶液为酸性时不能大量存在ClO-,C不符合;
D、通入足量CO2的溶液中,四种离子Na+、Cl-、K+、SO42-均不能发生离子反应,D符合;
6.由N2O和NO反应生成N2和NO2的能量变化如图所示。
若生成0.5molN2,下列说法不正确的是()
A.反应生成1molN2时转移4mole-
B.反应物能量之和大于生成物能量之和
C.N2O(g)+NO(g)=N2(g)+NO2(g)ΔH=-139kJ·
mol-1
D.断键吸收能量之和小于成键释放能量之和
【答案】A
由图可知反应物的总能大于生成物的总能量,反应为放热反应,可根据图中数据确定反应热。
【详解】A.由图可知发生的归中反应为N2O+NO=N2+NO2,N2O中N元素化合价从+1价降低到0价,NO中N元素化合价从+2价升高到+4价,生成1molN2时转移2mole-,A项错误;
B.由图可知反应物的总能大于生成物的总能量,B项正确;
C.ΔH==209kJ·
mol-1-348kJ·
mol-1=-139kJ·
mol-1,C项正确;
D.ΔH=反应物的总键能-生成物的总键能=139kJ·
mol-1<0,则有反应物的总键能小于生成物的总键能,即断键吸收能量之和小于成键释放能量之和,D项正确;
答案选A。
【点睛】解答本题的关键是ΔH的计算,ΔH==反应物的总键能-生成物的总键能。
7.下列事实能证明HCOOH为弱酸的是
A.可与Na2CO3反应生成CO2
B.常温时HCOONa溶液的pH大于7
C.导电能力低于同浓度硫酸
D.0.1mol/LHCOOH溶液可以使甲基橙变红
A、HCOOH能与Na2CO3反应产生CO2,只能说明醋酸的酸性比碳酸强(同理盐酸也可),故A错误;
B、常温时HCOONa溶液的pH大于7,溶液显碱性,说明HCOONa为强碱弱酸盐,醋酸是弱酸,故B正确;
C、导电性强弱与离子浓度有关,HCOOH为一元酸,硫酸为二元强酸,同浓度时,比较导电性,即使HCOOH是强酸,导电性也比硫酸低,故C错误;
D、0.1mol/LHCOOH溶液可以使甲基橙变红只能说明HCOOH溶液显酸性,故D错误。
点睛:
酸的溶解性及酸的通性无法确定酸的强弱,弱电解质的判断一般从三个方面分析:
①电离平衡方面,弱酸不完全电离,加水稀释平衡移动;
②对应的盐水解方面;
③与强酸对比,比较离子浓度或导电性。
本题中C选项为易错点,比较时要注意控制变量,可以通过比较同浓度时的HCOOH与HCl的导电性,来判断HCOOH是否为弱酸。
8.一定物质的量浓度溶液的配制和酸碱中和滴定是中学化学中两个典型的定量实验。
若要配制1mol·
L-1的稀硫酸标准溶液,用其滴定某未知浓度的NaOH溶液。
下列有关说法错误的是()
A.实验中用到的滴定管和容量瓶使用前都需要检漏
B.如果实验需用85mL的稀硫酸标准溶液,配制时可选用100mL容量瓶
C.用甲基橙作指示剂,滴定终点时,溶液颜色从红色变为橙色
D.酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸滴定,会导致测定的NaOH溶液浓度偏大
A.容量瓶有瓶塞,配制时需要摇匀,所以使用前必须检查是否漏水;
滴定管有旋塞或者橡胶管,使用前必须检查是否漏液,故A正确;
B.由于实验室中没有85mL容量瓶,所以需要选用100mL容量瓶配制1mol/L的溶液,故B正确;
C.甲基橙变色范围为3.1~4.4,颜色变化为:
红→橙→黄,用稀硫酸标准液滴定氢氧化钠溶液,滴定前溶液为黄色,当甲基橙由黄色变成橙色,且半分钟不褪色时,说明达到了滴定终点,如果溶液颜色从橙色变为红色,说明滴入的标准液过量,严重影响测定结果,故C错误;
D.滴定管在盛放酸或者碱溶液时必须润洗,否则会将待装液稀释,如:
酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,导致标准液浓度减小,滴定时消耗的标准液体积偏大,测得的NaOH溶液的浓度将偏大,故D正确;
9.一定温度下,水溶液中H+和OH-的浓度变化曲线如图。
下列说法正确的是( )
A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×
10-13
C.该温度下,加入FeCl3溶液可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
A、由图可知abc为等温线;
B、由b点计算此温度下水的离子积常数为1.0×
10-14;
C、b点到a点,氢离子浓度变大,氢氧根离子浓度减小,据此解答即可;
D、稀释不会引起水的离子积的改变,据此解答即可。
【详解】A、由图可知abc三点对应的平衡常数不变,故abc为等温线,故升高温度,不能由c到b,故A错误;
B、b点c(H+)=c(OH-)=1.0×
10-7mol/L,故Kw=1.0×
10-7×
1.0×
10-7=1.0×
10-14,故B错误;
C、加入FeCl3,氯化铁为强酸弱碱盐,铁离子结合水电离出的氢氧根,促进水的电离平衡右移,即氢离子浓度增大,氢氧根离子浓度减小(由b到a),符合图象变化趋势,故C正确;
D、由c点到d点,水的离子积常数减小,温度不变,KW不变,故不能利用稀释使其形成此变化,故D错误;
【点睛】曲线上的每一个点表示该温度下的平衡常数并且不变,所以abc三点相应的变化不能通过温度变化实现,由曲线以外的点变化到a、b、c三点则需要改变温度实现。
10.下列有关问题与盐的水解无关的是( )
A.NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂
B.NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
C.实验室中盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞
D.要除去FeCl3溶液中混有的Fe2+,可通入氧化剂Cl2
【详解】A、铁锈的成分