中考化学冲刺复习 知识点归纳汇总最新最全Word格式文档下载.docx
《中考化学冲刺复习 知识点归纳汇总最新最全Word格式文档下载.docx》由会员分享,可在线阅读,更多相关《中考化学冲刺复习 知识点归纳汇总最新最全Word格式文档下载.docx(21页珍藏版)》请在冰豆网上搜索。
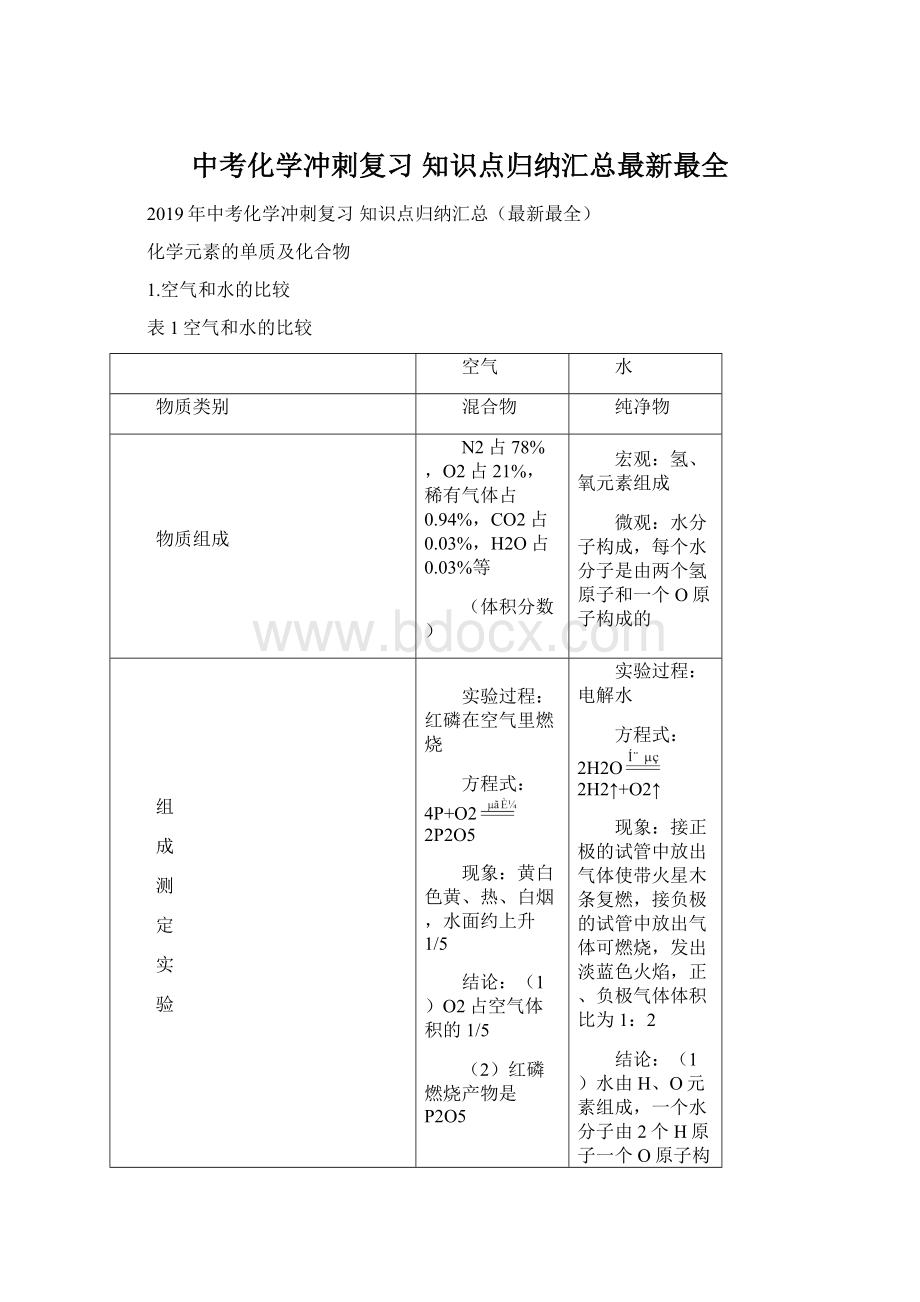
接正极的试管中放出气体使带火星木条复燃,接负极的试管中放出气体可燃烧,发出淡蓝色火焰,正、负极气体体积比为1:
2
(1)水由H、O元素组成,一个水分子由2个H原子一个O原子构成;
(2)化学反应中分子可再分,原子不可再分。
污
染
与
防
治
污染源
矿物燃料燃烧,工厂废气排放
工业三废和生活污水及农业生产中施加农药、化肥的水的排放
污染物
粉尘、气体(SO2、CO、NO2)
工业“三废”,化肥、农药、生活污水
防治
保护
认识保护环境的重要性,消除、减少污染源。
加强对水质的检测;
工业“三废”要经过处理后再排放;
农业上要合理使用化肥和农药等。
2.氧气、氢气、二氧化碳的比较
表2氧气、氢气、二氧化碳的比较
氧气(O2)
氢气(H2)
二氧化碳(CO2)
物理
性质
通常状况下:
无色、无味气体;
比空气重;
难溶于水;
熔、沸点很低。
无色、无味的气体;
比空气轻;
能溶于水;
加压、冷却易变成无色液体和雪状固体——干冰。
干冰可直接气化。
化学
化学性质活泼,能跟非金属、金属等多种物质发生氧化反应,具有氧化性。
常温下化学性质稳定,在点燃或加热条件下可跟许多物质发生反应,具有可燃性和还原性。
一般情况下:
不支持燃烧,不能燃烧,且不助呼吸;
跟水反应;
跟碱液反应。
制
法
工业
制法
分离液态空气法。
(物理变化)
电解水;
分离水煤气;
天然气等在催化剂作用下受热分解。
高温煅烧石灰石。
室
原
理
2KMnO4∆K2MnO4+MnO2+O2↑
∆
2KClO3MnO22KCl+3O2↑
活泼金属和稀酸反应:
Zn+2HCl=ZnCl2+H2↑
Zn+H2SO4(稀)=ZnSO4+H2↑
大理石(或石灰石)和稀盐酸反应。
CaCO3+2HCl=CaCl2+CO2↑+H2O
装
置
固体+固体气体
块状固体+液体→气体
收集
排水法或向上排空气法
排水法或向下排空气法
向上排空气法
检验
使带火星的木条复燃
点燃,火焰呈淡蓝色,不纯时有爆鸣声。
使澄清石灰水变浑浊
用途
供给呼吸;
气割气焊;
炼钢;
液氧炸药等。
充灌探空气球;
作高能燃料;
生产盐酸;
冶炼金属等。
灭火剂;
致冷剂;
人工降雨;
化工原料等。
3.一氧化碳、二氧化碳的比较
表3CO与CO2比较
名称
二氧化碳CO2
一氧化碳CO
俗名
碳酸气,固态时叫干冰
煤气
物理性质
无色、无味气体,比空气重,溶于水,凝固点为
无色、无味气体,有剧毒,比空气轻,难溶于水
化学性质
1燃烧也不支持燃烧。
②与水作用:
H2O+CO2=H2CO3
③与碱作用:
CO2+Ca(OH)2=CaCO3↓+H2O
④氧化性:
C+CO2高温2CO
是酸性氧化物。
①可燃性:
2CO+O2点燃2CO2
②还原性:
3CO+Fe2O3高温2Fe+3CO2
CO+CuO∆Cu+CO2
是不成盐氧化物。
①工业制法:
煅烧石灰石
CaCO3高温CaO+CO2
②实验室制法
碳不充分燃烧
2C+O2点燃2CO
②水煤气法:
C+H2O高温CO+H2
作灭火剂,致冷剂,用于人工降雨,作化工原料
作还原剂,冶炼金属、作气体燃料
4.氢气、碳、一氧化碳的比较
表4氢气、碳、一氧化碳的化学性质比较
H2
C
CO
可燃性
化学反应方程式
2H2+O2点燃2H2O
C+O2点燃CO2
反应现象
淡蓝色火焰,放热,火焰上所罩干冷烧杯壁上有水雾生成
无焰,发出白光,生成能使澄清的石灰水变浑浊的气体
蓝色火焰,放热,生成能使澄清的石灰水变浑浊的气体
还原性
CuO+H2∆Cu+H2O
2CuO+C高温2Cu+CO2
CuO+CO∆Cu+CO2
黑色粉末变为红色,试管壁上有水珠生成
黑色粉末变为红色,生成能使澄清的石灰水变浑浊的气体
5.有机化合物
表5甲烷、酒精、醋酸的性质和用途
沼气
酒精
醋酸
学名
甲烷
乙醇
乙酸
化学式
CH4
C2H5OH
CH3COOH
①无色无味气体②密度比空气小③极难溶于水
①无色透明液体②有特殊气味③易挥发④易溶于水和多种有机化合物
①无色透明液体②有强烈刺激性气味③易溶于水和酒精④易结冰(冰醋酸)
可燃性CH4+2O2CO2+2H2O
可燃性C2H5OH+3O22CO2+3H2O
酸性,能使紫色蕊变红色
①用作燃料
②发电
①作燃料;
②医用酒精作消毒剂;
③重要的化工原料,用来制醋酸、饮料、染料、香精等;
④作有机溶剂。
①食醋中含有乙酸;
②有机溶剂;
③重要的化工原料,可生产合成纤维、染料等。
秸杆、杂质等有机物甲烷
含淀粉的原料酒精
酒精醋酸
煤和石油的主要成分、形成、性质和主要用途
煤
石油
形成
古代植物遗体经过一系列复杂变化而形成的
古代动植物遗体在地壳中经过复杂变化而形成的
元素组成分类
主要成分是碳,还含有少量的氢、氮、硫和氧等元素以及无机矿物质,是一种复杂的混合物
主要成分是碳和氢,还含有少量的硫、氧和氮等元素,是一种混合物
重要的能源及化工原料
6.铁的化学性质
发生的现象
结论
铁与非金属单质(氧气)的反应
(1)常温下,干燥的空气中,铁器表面无变化。
(1)常温下干燥的空气中铁较稳定。
(2)常温下,潮湿空气中,铁表面出现红棕色物质。
(2)常温下铁在潮湿空气中与氧气反应而生锈。
(3)细铁丝在氧气中燃烧,火星四射,生成黑色固体,放出大量的热。
(3)3Fe+2O2Fe3O4
铁与化合物的反应
酸
稀HCl
铁钉上出现气泡,试管中液体的颜色由无色逐渐变为浅绿色。
Fe+2HCl=FeCl2+H2↑
稀H2SO4
Fe+H2SO4(稀)=FeSO4+H2↑
盐
CuSO4
溶液
铁上出现红色物质,溶液颜色变淡。
Fe+CuSO4=FeSO4+Cu
2019年中考化学提分复习知识二
元素的单质及化合物
1.酸、碱、盐的性质
浓盐酸
浓硫酸
浓硝酸
HCl
H2SO4
HNO3
色态味
无色透明、有刺激性气味液体(工业盐酸略带黄色)
无色透明、粘稠、油状液体,无刺激气味
无色透明,有刺激性气味液体
溶解性
易溶
易溶于水,强烈放热
沸点、
挥发性
沸点低,易挥发(白雾)敞口放置质量、浓度均减小
高沸点,不易挥发
吸水性
无
用作干燥剂,敞口放置质量增加、浓度减小
脱水性
能使纸张、木材碳化
稳定性
稳定性酸,受热或见光难分解
见光或受热易分解
强氧化性
与氢前金属反应,放出氢气
能与许多金属发生反应,但不生成氢气
稀盐酸、硫酸、硝酸化学性质比较
稀盐酸HCl
稀硫酸H2SO4
稀硝酸HNO3
相对分子质量
36.5
98
63
电离方程式
HCl=H++Cl-
H2SO4=2H++SO42-
HNO3=H++NO3-
与指示剂作用
紫色石蕊试液→变红,无色酚酞试液→不变色
与金属反应
Zn+2HCl=ZnCl2+H2↑
Zn+H2SO4(稀)=ZnSO4+H2↑
能发生反应,但不生成H2,生成H2O
与金属氧化物反应
Fe2O3+6HCl=2FeCl3+3H2O
Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
ZnO+2HNO3=Zn(NO3)2+H2O
与碱反应
Cu(OH)2+2HCl=CuCl2+2H2O
Cu(OH)2+H2SO4=CuSO4+H2O
Mg(OH)2+2HNO3=Mg(NO3)2+H2O
与盐反应
HCl+AgNO3=AgCl↓+HNO3
BaCl2+H2SO4=BaSO4↓+2HCl
Na2CO3+2HNO3=2NaNO3+H2O+CO2↑
常用鉴别方法
AgNO3溶液和稀HNO3,生成不溶于稀HNO3的白色沉淀;
能与碳酸盐反应生成CO2
BaCl2或Ba(NO3)2或Ba(OH)2溶液和稀HNO3,生成不溶于稀HNO3的白色沉淀;
化工产品,除锈,制药
化工产品,化肥、农药、炸药、染料、除锈、精炼石油
化工产品,化肥、染料、火药、
酸的通性:
①使紫色石蕊变红,无色酚酞不变色。
②活泼金属+酸→盐+H2↑。
(属于置换反应)
③金属氧化物+酸→盐+水。
(属于复分解反应)④金属氢氧化物(碱)+酸→盐+水。
(属于复分解反应)
⑤盐+酸→新盐+新酸。
两种常见的碱的性质。
氢氧化钠
氢氧化钙
俗称
火碱、烧碱、苛性钠
熟石灰、消石灰(溶液为石灰水)
NaOH
Ca(OH)2
40
74
NaOH=Na++OH-
Ca(OH)2=Ca2++2OH-
色态
白色固体
白色粉末状固体
吸湿性
有强吸湿性,在空气中吸收水分,潮解
无吸湿性(CaO有吸湿性)
极易溶于水,强烈放热
微溶于水,溶解度随温度升高而减小
腐蚀性
有强腐蚀性
使指示剂变色
①使紫色石蕊试液变蓝
②使无色酚酞试液变红
③使湿润的红色石蕊试纸变蓝
跟酸性氧化物反应
2NaOH+CO2=Na2CO3+H2O
2NaOH+SO2=Na2SO3+H2O
Ca(OH)2+CO2=CaCO3↓+H2O
Ca(OH)2+SO2=CaSO3↓+H2O
跟酸发生中和反应
NaOH+HCl=NaCl+H2O
2NaOH+H2SO4=Na2SO4+2H2O
3NaOH+H3PO4=Na3PO4+3H2O
Ca(OH)2+2HCl=CaCl2+H2O
Ca(OH)2+H2SO4=CaSO4+2H2O
3Ca(OH)2+2H3PO4=Ca3(PO4)2↓+6H2O
跟某些盐反应