浙教版九年级科学化学综合实验探究题.docx
《浙教版九年级科学化学综合实验探究题.docx》由会员分享,可在线阅读,更多相关《浙教版九年级科学化学综合实验探究题.docx(19页珍藏版)》请在冰豆网上搜索。
浙教版九年级科学化学综合实验探究题
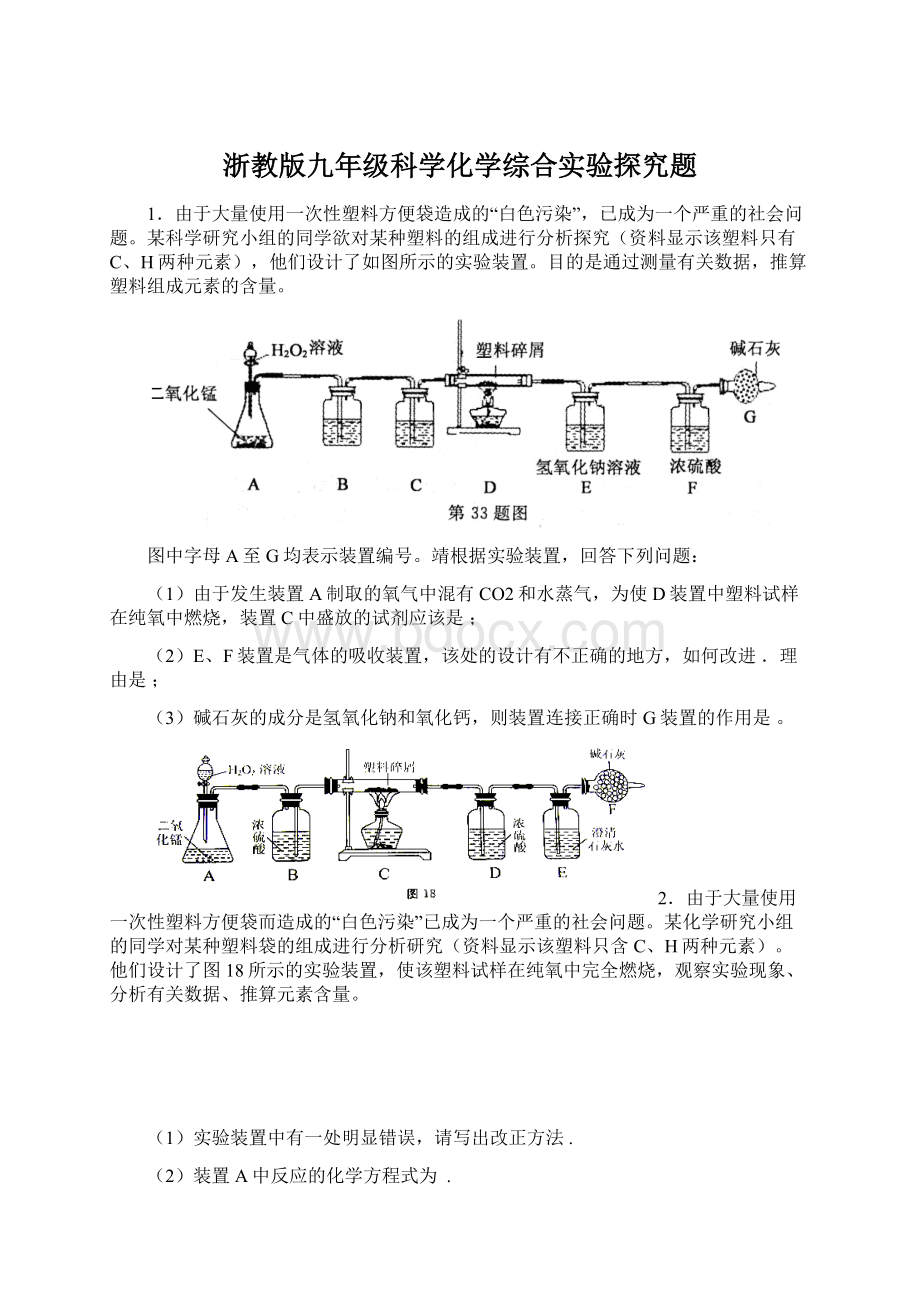
1.由于大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题。
某科学研究小组的同学欲对某种塑料的组成进行分析探究(资料显示该塑料只有C、H两种元素),他们设计了如图所示的实验装置。
目的是通过测量有关数据,推算塑料组成元素的含量。
图中字母A至G均表示装置编号。
靖根据实验装置,回答下列问题:
(1)由于发生装置A制取的氧气中混有CO2和水蒸气,为使D装置中塑料试样在纯氧中燃烧,装置C中盛放的试剂应该是;
(2)E、F装置是气体的吸收装置,该处的设计有不正确的地方,如何改进.理由是;
(3)碱石灰的成分是氢氧化钠和氧化钙,则装置连接正确时G装置的作用是。
2.由于大量使用一次性塑料方便袋而造成的“白色污染”已成为一个严重的社会问题。
某化学研究小组的同学对某种塑料袋的组成进行分析研究(资料显示该塑料只含C、H两种元素)。
他们设计了图18所示的实验装置,使该塑料试样在纯氧中完全燃烧,观察实验现象、分析有关数据、推算元素含量。
(1)实验装置中有一处明显错误,请写出改正方法.
(2)装置A中反应的化学方程式为.
(3)装置E中的现象是,装置F的作用是
(4)若装置C的玻璃管中放入的塑料试样质量为5.9g,塑料试样充分燃烧后,装置D增重7.2g,则该塑料试样中含氢元素的质量为g;假设塑料的组成为CxHy,则装置C的玻璃管中反应的化学方程式为(化学计量数用含x、y的代数式表示,且可以是分数)
(5)若装置中没有连接装置B,将使该塑料试样中氢元素的质量测算结果(填“偏小”、“偏大”或“无影响”)
(6)若此塑料为聚氯乙烯则生成物中会有_____检验此物质应在____和____之间加_________
3.某化学兴趣小组的同学在活动中展示了一套如下图所示实验装置(假设每步均完全反应,氧化铁样品中的杂质不参加反应)。
查阅资料:
草酸在浓硫酸存在时加热发生如下反应:
通过讨论,同学们对这套装置有了多种认识。
(1)第一组同学说:
从实验安全和实验操作程序看,首先要检查装置的气密性,实验开始时先加热________(填A或D)处的酒精灯,实验结束时先熄灭________(填A或D)处的酒精灯。
(2)第二组同学说:
用该装置可以进行一氧化碳与氧化铁反应的实验,其中B装置的作用为________________;E装置的作用为________________;一氧化碳与氧化铁反应的化学方程式为________________。
(3)第三组同学说:
用该装置还可以测定氧化铁样品中氧化铁的质量分数。
他们的测定方法是:
称取氧化铁样品10g,样品与玻璃管的总质量为60.0g,完全反应并冷却后再称量玻璃管与剩余固体的总质量为57.6g。
则实验测得氧化铁样品中氧化铁的质量分数为_____________。
(4)第四小组的同学说:
利用这套装置还有另一种测定样品中氧化铁的质量分数的方法,即先称量氧化铁样品的质量,再分别称量E装置在反应前后的总质量,即可计算求得样品中氧化铁的质量分数。
但按此方法实际测定结果却偏大,分析造成偏大的原因可能是
_______________________________________。
4.过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验。
【实验目的】测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度。
【实验原理】2Na2CO4+4HCl=====4NaCl+2CO2↑+O2↑+2H2O
【实验装置】
【交流与讨论】
Ⅰ.甲同学认为测定产物中O2的体积即可测定样品的纯度。
(1)装置②的作用是:
;
(2)装置③的作用是:
;
(3)称取适量样品与足量浓盐酸充分反应后,收集到的氧气的体积为0.25L(已知该实验条件下氧气的密度为1.28g/L),则称取的样品质量应大于g;
Ⅱ.乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度。
但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是;(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
Ⅲ.丙同学提出了一种新方案,得到了大家的一致认可:
称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7g。
则该样品的纯度为。
5.某无色气体中可能含有甲烷、一氧化碳、二氧化碳、氮气中的一种或几种,现将该气体依次通过下图所示装置,观察到:
①A.装置内未见有浑浊出现;②D装置内无水硫酸铜变蓝(无水硫酸铜遇水变蓝);最终收集到一定量干燥气体(假设每步反应都是完全的)。
请回答下列问题:
(1)由①可知原混合气体中肯定不含_________;
(2)由②可知原混合气体中一定含有__________;
(3)最终收集到的气体是_____________;
(4)实验过程中记录的实验数据如下:
D装置总质量
E、F装置总质量
反应前
156.6g
356.8g
反应后
158.4g
359.0g
则该气体的成分为:
__________________。
6.某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。
实验步骤如下:
①按图连接装置,并检查气密性;②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为83.4g;③准确称得6g纯碱样品放入容器b中;④打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;⑤打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为85.6g。
试回答:
(1)鼓入空气的目的是 ,装置A中试剂X应选用 ;
(2)若没有C装置,则会导致测定结果 ▲ (填“偏大”或“偏小”);
(3)E装置的作用是 ;
(4)根据实验中测得的有关数据,计算出纯碱样品Na2CO3的质量分数为 (计算结果保留一位小数)。
7.某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。
实验步骤如下:
①按图连接装置,并检查气密性;②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为A克;③准确称得B克纯碱样品放入容器b中;④连接装置;⑤打开分液漏斗a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;⑥打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为C克。
试回答:
(1)若⑤⑥两步的实验操作太快,则会导致测定结果(填“偏大”或“偏小”);
(2)步骤⑥的目的是,装置A中试剂可选用;
(3)若没有C装置,则会导致测定结果(填“偏大”或“偏小”);
(4)E装置的作用是;
(5)某同学认为此实验还缺少一个步骤,会影响实验结果。
你认为缺少的步骤是。
增加这步骤的目的是。
8.已知某纯碱试样中含有杂质氯化钠为测定试样中纯碱的质量分数,可用下图装置进行实验。
主要步骤如下,请填空:
①按图组装仪器,并检查__________________;②将10g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;③称量盛有碱石灰的U形管的质量为300g;④从分液漏斗中滴入20%的稀硫酸,直到____________为止,写出反应的化学方程式__________________________;⑤从导管A处缓缓鼓入一定量的空气;⑥再次称量盛有碱石灰的U形管的质量;⑦重复⑤和⑥的操作,直到U形管的质量基本不变,测得质量为303.3g。
回答下列问题:
(1)装置中浓硫酸的作用是___________________________________。
(2)步骤⑤的目的是_________________________________________。
(3)试样中纯碱的质量分数为_________________________________。
(4)分液漏斗中的稀H2SO4不能换成浓盐酸,理由是______________________________。
(5)若用生成沉淀的方法来测定试样中纯碱的质量分数,应选用的试剂是____________。
9.小明暑假里去北京旅游,发现他所住宾馆的电热水壶里有很多水垢。
水壶的水烧开后,水面还漂着一层白色的东西。
他设法取了一些水垢,准备回校后与同学小军一起做进一步的探究。
【研究课题】探究水壶底部水垢的主要成分,并通过实验测定某主要成分的含量。
【查阅资料】小明通过查阅资料知道,天然水中一般都含有Ca2+、Mg2+、HCO等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐、碱等混合物)。
同时,他还查阅到有关物质的溶解性:
物质
Ca(HCO3)2
Mg(HCO3)2
Ca(OH)2
Mg(OH)2
CaCO3
MgCO3
溶解性
可溶
可溶
微溶
不溶
不溶
微溶
【提出猜想】
(1)水垢的主要成分一定含有Mg(OH)2和,可能含有Ca(OH)2和。
【设计方案】
(2)小明同学在烧杯中放入少量研碎的水垢,加入适量蒸馏水,充分搅拌后,取适量上层清液于试管中,再,没有白色沉淀产生,说明水垢中无Ca(OH)2。
(3)小军设计了如图甲所示的实验装置,测定水垢中碳酸盐的含量。
实验步骤如下:
①按图甲组装仪器,将50克水垢试样放入锥形瓶中,加入足量的某酸溶液。
该实验中检查装置的气密性的操作应在加入样品(选填“前”或“后”)进行。
小军所加的酸是。
②测量5分钟内干燥管内物质增加的质量,(如图乙所示),从图乙看出,第3.5分钟~第5分钟,干燥管内物质增加的质量都是16.5g,这说明。
假设该水垢只含一种碳酸盐,则该水垢中含该种碳酸盐的质量分数为。
(4)小明觉得小军测得的该水垢中含该种碳酸盐的质量分数与实际的含量相比会偏低,为减小实验误差,你采取的措施是。
10.某校化学小组对热水壶底部水垢的主要成分进行了如下探究,请完成以下活动,并回答相关问题。
【查阅资料】天然水中含有Ca2+、Mg2+、HCO3-等离子,在加热条件下,这些离子趋于生成溶解度更小的物质——水垢(主要成分为碳酸盐和碱)。
有关物质的溶解性见下表:
部分钙、镁化合物的溶解性表(20℃)
【提出猜想】水垢的主要成分中一定含有__________和__________(填化学式),可能含有Ca(OH)2和MgCO3。
【设计方案】实验1:
确定水垢中是否含Ca(OH)2和CaCO3。
实验步骤
实验现象
结论
在少量研碎的水垢中加入适量的蒸馏水充分搅拌,过滤,在滤液中加入溶液
没有白色沉淀产生
_________________
_________________
实验2:
确定水垢中是否含MgCO3。
利用下列实验装置,完成实验2探究。
其主要实验步骤如下:
称量D、E装置的总质量为600.00g,按上图组装后,将2.50g水垢试样放入锥形瓶中,加入足量稀盐酸,待锥形瓶中不再产生气泡时,打开止水夹K,从导管a处缓缓鼓入空气,一段时间后称量装置D、E的总质量为601.25g(碱石灰的主要成分为CaO和NaOH,不考虑装置内空气对实验的影响)。
【实验讨论】
(1)加入样品前还应________,