学年鲁教版初三化学上《维持生命之气氧气》章末知识梳理+例题演练Word文档下载推荐.docx
《学年鲁教版初三化学上《维持生命之气氧气》章末知识梳理+例题演练Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《学年鲁教版初三化学上《维持生命之气氧气》章末知识梳理+例题演练Word文档下载推荐.docx(12页珍藏版)》请在冰豆网上搜索。
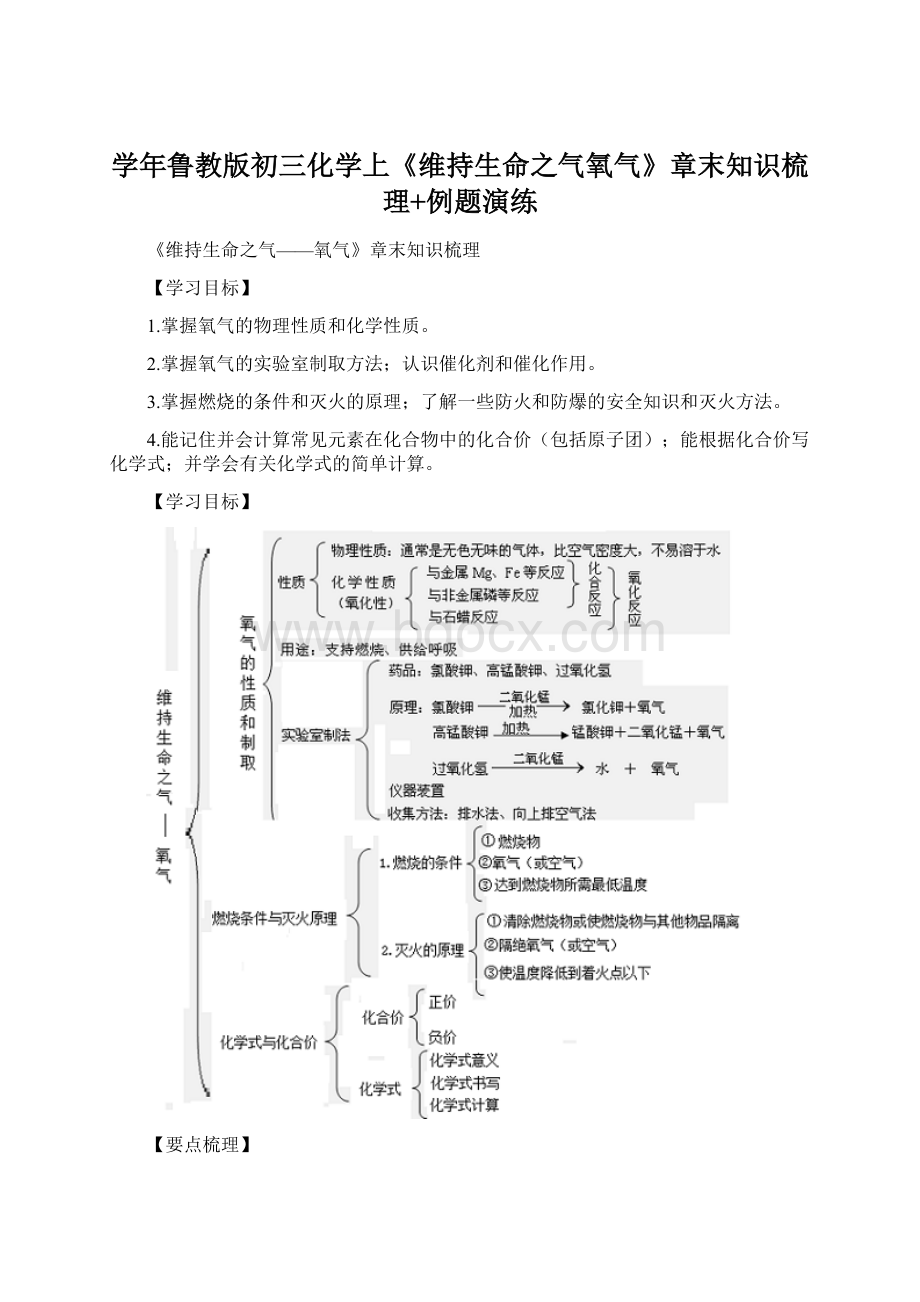
反应后
文字表达式
木炭和
氧气
点
燃
持续红热,放出
热量
剧烈燃烧,发出白光,放出热量
生成使澄清石灰水变浑浊的气体
碳+氧气二氧化碳
铁丝和
灼烧至红热,离火后迅速变凉(不能燃烧)
剧烈燃烧,火星四射,放出热量
生成黑色固体
铁+氧气四氧化三铁
蜡烛和
放出热量,产生黄色火焰,分三层(外焰、内焰、焰心),有少量黑烟
剧烈燃烧,放出热量,火焰颜色呈白色(发出白光),并产生白雾(石蜡蒸汽),没有
黑烟产生
生成能使澄清石灰水变浑浊的气体和水
蜡烛+氧气二氧化碳+水
硫磺和
发出微弱的淡蓝色火焰,放出
发出明亮的蓝紫色火焰,放出
生成有刺激性气味的
气体
硫+氧气二氧化硫
要点二、实验室制取氧气
1.反应原理和实验装置:
(1)分解过氧化氢溶液制取氧气(实验装置如下图B或C所示)
过氧化氢水+氧气
(2)加热高锰酸钾(紫黑色固体)制取氧气(实验装置如下图A所示)
高锰酸钾锰酸钾+二氧化锰+氧气
(3)加热氯酸钾(白色固体)制取氧气(实验装置如下图A所示)
2.收集方法:
(1)排水集气法:
如上图E(因为氧气不易溶于水)
(2)向上排空气集气法:
如上图F(因为氧气密度比空气大)
3.验满方法:
(1)排水集气法:
当有气泡从集气瓶口冒出来,说明氧气已收集满。
(2)向上排空气集气法:
把带火星的木条靠近集气瓶口,如果木条复燃,说明氧气已收集满。
4.检验方法:
将带火星的小木条伸入集气瓶内,如果木条复燃,说明该瓶内气体是氧气。
分解过氧化氢制取氧气的发生装置也可以使用上图D所示装置,这样就可以通过调节分液漏斗的活塞来控制液体的滴加速度,从而可以控制反应速率,得到比较稳定的氧气流。
要点三、催化剂和催化作用
1.催化剂:
在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都没有发生变化的物质叫做催化剂(又叫作触媒)。
2.催化作用:
催化剂在化学反应中所起的作用叫催化作用。
催化剂的特点:
“一变二不变”,“一变”是改变反应速率,“二不变”是反应前后质量不变,化学性质不变。
要点四、化合反应、分解反应与氧化反应
1.化合反应:
由两种或两种以上物质生成另一种物质的反应,叫做化合反应。
(多变一)。
2.分解反应:
一种物质生成两种或两种以上其他物质的反应,叫做分解反应(一变多)。
3.氧化反应:
凡是物质与氧发生的反应称为氧化反应。
1.缓慢氧化:
有些氧化反应进行的很慢、不易被察觉,这种氧化反应叫缓慢氧化。
如:
铁生锈、动植物呼吸、食物腐烂等。
2.化合反应和分解反应都属于基本反应类型,而氧化反应不属于基本反应类型。
要点五、燃烧和灭火
1.燃烧:
可燃物与氧气发生的一种发光、放热的剧烈氧化反应叫做燃烧。
2.物质燃烧需要三个条件:
(1)物质具有可燃性;
(2)可燃物与空气或氧气接触;
(3)可燃物达到它燃烧所需要的最低温度(即它的着火点)。
3.灭火的原理:
(1)燃烧物与其他可燃物隔离或清除掉可燃物;
(2)使燃烧物隔绝空气(或氧气);
(3)使燃烧物的温度降到着火点以下。
1.着火点是燃烧物固有的性质,不随外界条件的改变而改变。
不同物质的着火点不同,每种物质具有对应的着火点。
着火点是物质本身的固有属性,因此不能说用降低着火点的方法来灭火,而只能使降温到着火点以下。
2.灭火原理实际就是破坏燃烧的条件。
不同的物质燃烧引起的火灾,其灭火的方法不尽相同,如家用电器着火、森林火灾、档案室火灾等与普通火灾灭火方法不同。
要点六、化学式
化学式的定义:
用元素符号和数字的组合表示物质组成的式子,叫做化学式。
化合物化学式的书写:
类型
写法
读法
举例
两原子化合型
1氧化物:
氧元素在右边,其他元素在左边
2金属元素与非金属元素组成的化合物:
金属在左,非金属在右
1从后往前读作“某化某”
2读出每种元素的原子个数,个数为1,一般不读
MgO氧化镁
P2O5五氧化二磷
NaCl氯化钠
MgCl2氯化镁
多原子化合型
原子团一般在右边,其他元素在左边
1以原子团命名
2以中心原子命名
NaOH氢氧化钠
H2SO4硫酸
Na2CO3碳酸钠
要点七、化合价
元素的化合价是元素的原子之间形成化合物时表现出来的一种性质,用来表示原子之间相互化合的数目。
1.在化合物中氢元素通常显+1价;
氧元素通常显-2价;
在氧化物中氧元素显-2价,其他元素显正价;
金属元素与非金属元素化合时,金属元素显正价,非金属元素显负价。
2.在单质中,元素的化合价为零。
3.化合物中各元素的化合价代数和为零。
要点八、化学式的计算
1.相对分子质量:
化学式中各原子的相对原子质量的总和,叫做相对分子质量,用符号Mr表示。
2.化合物中的原子个数之比:
在化学式中,元素符号右下角的数字就是表示该元素原子的个数,因此这些数字的比值就是化合物中的原子个数之比。
3.组成化合物各元素的质量比:
即各元素的相对原子质量总和的比。
4.化合物中某元素的质量分数=。
5.一定质量的物质中某元素的质量=物质的质量×
该元素在物质中的质量分数。
基本计算类型(以Fe2O3为例):
计算物质的相对分子质量
Fe2O3的相对分子质量=56×
2+16×
3=160
计算组成物质的各元素质量比
Fe2O3中各元素的质量比是:
铁元素:
氧元素=(56×
2):
(16×
3)=7:
3
计算物质中某元素的质量分数
Fe2O3中Fe的质量分数=【56×
2/(56×
3)】×
100%
=(112/160)×
100%=70%
计算一定量化合物中某元素的质量
例:
50吨Fe2O3中含铁元素多少吨?
解:
【50吨×
56×
100%=50吨×
70%=35吨(答略)
【典型例题】
【答案】C
类型一、考查氧气的性质
1.下列应用,利用了氧气物理性质的是( )
A.工业上用空气制氧气B.用氧气气焊金属
C.氧气供潜水员呼吸D.用氧气炼钢
【思路点拨】本题考查氧气的性质,氧气的物理性质是:
在通常情况下是无色、无味的气体,密度比空气略大,不易溶于水。
化学性质是:
氧气是比较活泼的气体,具有助燃性和氧化性。
【答案】A
【解析】A.工业制氧气利用的是液态氧气和液态空气的沸点不同,属于物理性质;
B.气焊金属是利用了氧气的助燃性,属于化学性质;
C.供潜水员呼吸是利用了氧气的供给呼吸,属于化学性质;
D.冶炼钢铁是氧气的助燃性,属于化学性质。
【总结升华】氧气的性质和用途是最基础的考点之一,也体现了性质决定用途,用途又反映性质的理念。
举一反三:
【变式】在氧气中燃烧,产生明亮的蓝紫色火焰,且有刺激性气味的气体产生的是()
A.木炭B.硫C.红磷D.铁丝
【答案】B
类型二、考查实验室制取氧气
2.关于反应2KClO32KCl+3O2↑的说法,错误的是( )
A.MnO2做该反应的催化剂B.MnO2的质量随着反应减少
C.MnO2加快KClO3的分解速率D.MnO2的化学性质没有改变
【思路点拨】在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在反应前后都没有发生变化的物质叫做催化剂(又叫触媒);
催化剂的特点可以概括为“一变二不变”,一变是能够改变化学反应速率,二不变是指质量和化学性质在化学反应前后保持不变;
据此结合氯酸钾分解制取氧气的反应原理,进行分析解答。
【答案】B
【解析】实验室用氯酸钾和二氧化锰加热制取氧气的化学方程式如下:
2KClO32KCl+3O2↑在此反应中,MnO2是催化剂;
起催化作用;
故A选项正确;
催化剂的特点可以概括为“一变二不变”,在此反应中,MnO2是催化剂,故在此反应前后,MnO2的质量和化学性质都不变,故B选项错误;
MnO2是催化剂,加快KClO3的分解速率,故C选项正确;
在此反应中,MnO2是催化剂,故在此反应前后,MnO2的质量和化学性质都不变,故D选项正确。
【总结升华】本题考查对催化剂概念的理解,掌握催化剂的特征(“一变二不变”)是正确解答本题的关键。
举一反三:
【变式】实验室用高锰酸钾制取氧气,实验结束前需要进行的操作是()
A.先把试管取下,再熄灭酒精灯
B.先熄灭酒精灯,再把导管从水槽中取出
C.先把导管从水槽中取出,再熄灭酒精灯
D.先熄灭酒精灯,再取下试管,最后把导管从水槽中取出
类型三、考查化合反应、分解反应与氧化反应
3.下列化学变化中不属于化合反应的是________(填序号,下同),既属于化合反应又属于氧化反应的是________。
A.硫+氧气二氧化硫B.铁+氧气四氧化三铁
C.酒精+氧气二氧化碳+水 D.氢气+氧气水
【答案】CABD
【解析】C是氧化反应,不是化合反应;
A、B、D既是氧化反应,又是化合反应。
【总结升华】化合反应的特点是“多变一”,物质与氧气发生的反应都属于氧化反应。
【变式】下列反应中属于分解反应的是,既属于化合反应又属于氧化反应的是。
A.石蜡+氧气二氧化碳+水 B.碳+氧气二氧化碳
C.二氧化碳+水碳酸 D.过氧化氢水+氧气
【答案】DB
类型四、考查催化剂和催化作用
4.有关催化剂的说法正确的是( )
A.催化剂在化学反应中起催化作用
B.催化剂在化学反应前后质量和化学性质都改变
C.催化剂只能加快化学反应速率
D.过氧化氢制氧气必须用二氧化锰作催化剂
【解析】催化剂是能改变其他物质的化学反应速率而本身的质量和化学性质都不变的物质。
【总结升华】催化剂的特点是“一变二不变”:
一变是改变反应速率,二不变是反应前后质量不变,化学性质不变。
【变式】在化学反应里能其他物质的化学反应,而本身的和在反应前后都没有发生变化的物质叫做。
【答案】改变速率质量化学性质催化剂
类型五、考查燃烧与灭火
5.下图甲和乙所示实验方法均可用来探究可燃物燃烧的条件。
经查阅资料知:
白磷着火点为40℃,红磷着火点为240℃,它们在空气中燃烧都生成有毒的白烟——五氧化二磷,五氧化二磷易溶于水。
(1)某同学用图甲所示装置进行实验,观察到的现象是。
(2)另一同学用图乙所示装置进行实验,得到以下实验事实:
①不通空气时,冷水中的白磷不燃烧;
②通空气时,冷水中的白磷不燃烧;
③不通空气时,热水中的白磷不燃烧;
④通空气时,热水中的白磷燃烧。
该实验中,能证明可燃物通常需