最新11级生物技术1班发酵工程实验计划方案汇总Word文档下载推荐.docx
《最新11级生物技术1班发酵工程实验计划方案汇总Word文档下载推荐.docx》由会员分享,可在线阅读,更多相关《最新11级生物技术1班发酵工程实验计划方案汇总Word文档下载推荐.docx(15页珍藏版)》请在冰豆网上搜索。
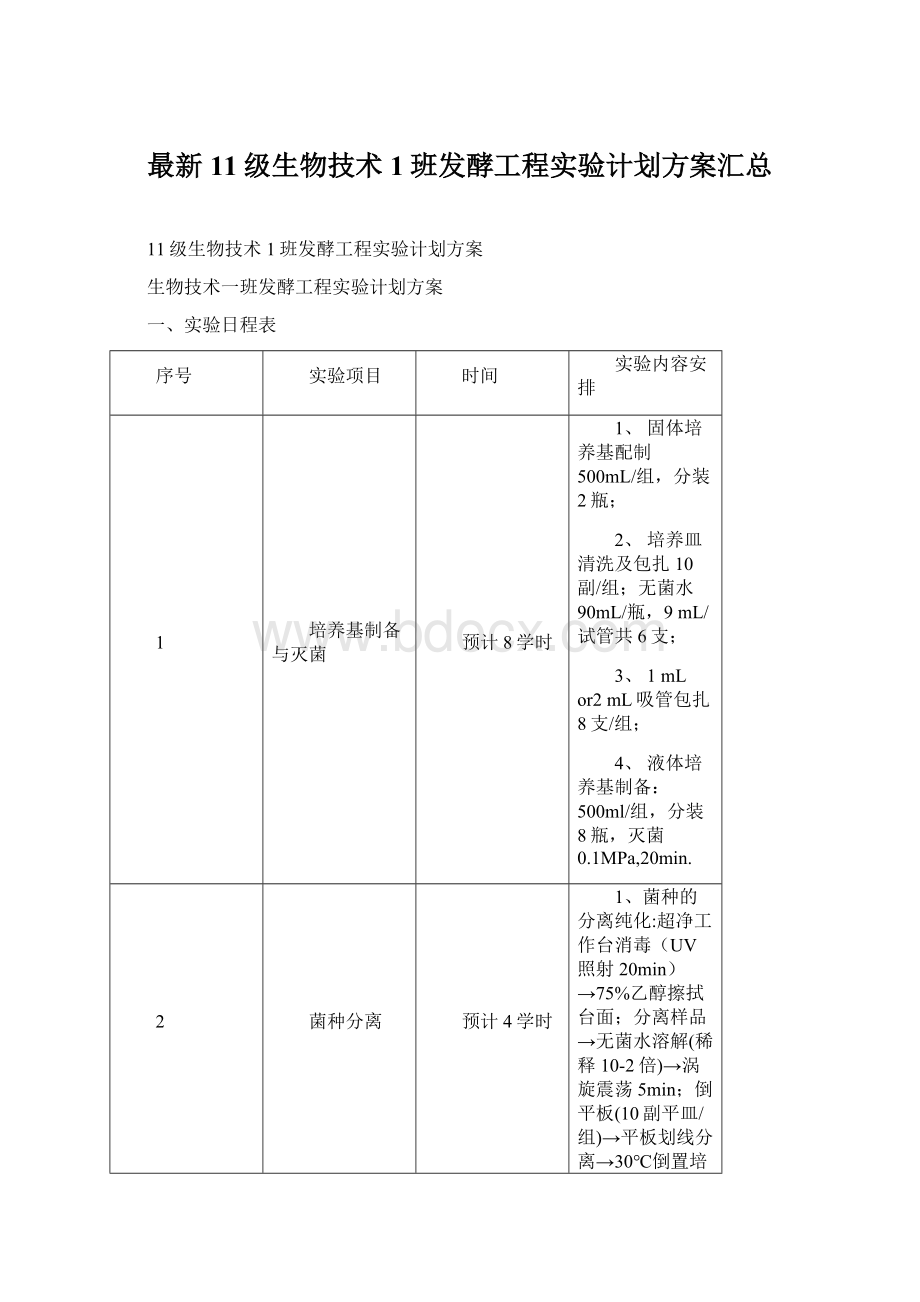
超净工作台消毒(UV照射20min)→75%乙醇擦拭台面;
分离样品→无菌水溶解(稀释10-2倍)→涡旋震荡5min;
倒平板(10副平皿/组)→平板划线分离→30℃倒置培养→目标菌株获得→制片及观察(显微摄影)。
3
种子制备
1、接种准备工作:
超净工作台消毒(UV照射20min)→75%乙醇擦拭台面。
2、纯种培养接种:
平板单一菌落→种子培养基(2环/瓶)→涡旋震荡3-5min;
3、摇瓶培养:
摇床设置及调节(30℃,200r/m)→摇瓶固定→启动培养。
4
发酵罐结构认识、操作规程及分批发酵操作
1、发酵培养基配制:
20Lor35L。
2、发酵罐操作培训:
发酵罐初始状态检查及调节→清洗(清水冲洗2-3遍)→发酵罐运行启动→发酵罐运行参数设置→空罐灭菌(0.15MPa,20min)→进料→实罐灭菌(0.1MPa维持30min)→冷却→火焰封口接种→发酵参数稳定状态调节与维持。
3、发酵取样:
取样管灭菌→取样→再灭菌;
4、发酵中间过程分析(0hour):
pH测定(pH计or精密试纸);
酸度(中和法);
酶浓度测定(福林酚法);
菌体浓度测定(A600光密度法)
5、中间取样:
每间隔4h,取样管灭菌→取样→再灭菌.共计4-6次;
6、发酵结束工作:
器皿、设备还原,环境清洁
2、实验分组
第一组:
薛盛、张川、周宁、殷清玉宇、周辰栋、杨朝伟、吴迪、
刘洋、刘丽婷(负责人:
吴迪)
第二组:
张怡、沈飞、徐依依、陆佳桦、吴冰燕、王芸清鉴、叶晨、汪素红、刘杏、刘文跃(负责人:
沈飞)
第三组:
田玉寒、闻宁、林飞敏、李林棋、丁铭、周欣欣、罗斯、
蒋秋艳、刘宇霞(负责人:
田玉寒)
3、时间分配
前三周的周二晚发酵理论课照上,因此各组的固定实验时间如下:
第一组固定实验时间:
周一下午、周三晚上
第二组固定实验时间:
周二中午、周四上午
第三组固定实验时间:
周五下午、周五晚上
后三周的周二晚无理论课,各组集中在周二晚实验
前三周每周安排两次实验,以获取更多的实验数据,后三周每周一次集体实验
几个重要时间节点为:
第10周正式进入实验程序;
第13周获得目标菌株1株;
第14周完成种子的摇瓶培养;
第15周分别完成上罐发酵;
第16周实验收尾工作。
四、实验内容
实验一产蛋白酶微生物菌株的分离
【实验材料】
1、采样样品
食堂泔脚等残存蛋白质丰富的环境周围的土壤或其它蛋白质腐败材料。
2、培养基
(1)增殖培养基:
蛋白胨10g/L,牛肉膏3g/L,氯化钠5g/L,pH7.0~7.2,0.1MPa,灭菌20min。
(2)分离纯化培养基:
酪蛋白10g/L,Na2HPO46g/L,KH2PO43g/L,NaCl0.5g/L,NH4Cl1g/L,FeSO40.025g/L,酵母膏0.2g/L,MgSO40.24g/L,CaCl20.011g/L,溴百里香酚兰0.05g/L,琼脂20g/L,pH7.0~7.2,0.1MPa,灭菌20min。
(3)菌种保存培养基:
蛋白胨10g/L,牛肉膏3g/L,NaCl5g/L,琼脂20g/L,pH7.0~7.2,0.1MPa,灭菌20min。
(4)无菌水:
90mL无菌水/250mL三角瓶;
9mL无菌水/试管6支。
3、实验器材
刮铲、一次性手套、无菌小塑料袋、试管、三角瓶、培养皿、吸管、接种环和涂布棒等。
4、实验设备
涡旋振荡器、超净工作台、高压灭菌锅、振荡培养箱、恒温培养箱、(数码)显微镜。
【实验步骤】
1、采样
分别取食堂泔脚池周边土壤,腐烂基质或其它可能含有蛋白酶生产菌的生物制剂10g装入无菌小塑料袋,在超净工作台上将样品混合均匀从中称取1g作为待增殖的采样样品。
2、增殖培养
1g待增殖的采样样品加入50mL增殖培养基/250mL三角瓶中,涡旋振荡器上振荡5min,可设置3组平行。
混匀的液体置于30℃,180r/min振荡培养箱中摇瓶培养36h。
增殖后的培养液置于80℃水浴中加热10min去除营养体细胞,迅速取出冷却至常温,待用。
平行样可以在加热处理后再合并成一个样作为增殖培养液。
3、增殖液梯度稀释
在超净工作台中取增殖培养液10mL加入装有90mL无菌水的250mL三角瓶中,静置5min后用涡旋振荡器上振荡5min,制成10-1稀释菌液。
用无菌吸管吸取1mL10-1稀释菌液加入9mL无菌水试管中,涡旋振荡器1min制成10-2稀释菌液,再依次用无菌吸管吸取1mL稀释菌液加入9mL无菌水试管中梯度稀释成10-3、10-4、10-5、10-6、10-7倍稀释菌液。
4、平板涂布
分别取0.1mL10-6、10-7稀释菌液于分离培养基平板上,用无菌涂布棒分别涂布均匀,每一稀释度重复5个平行。
5、培养
将涂布好的平板放入30℃微生物恒温培养箱中倒置培养36h后,观察培养结果,统计总菌数、菌落种类及各自比例。
6、菌株鉴别及纯化
挑取菌落周围培养基变蓝色的典型菌落,在保存培养基平板上划线纯化至单一菌落。
显微观察菌体形态。
纯化后的纯菌落作斜面菌种保藏作为后续实验的备用菌种。
【实验结果】
1、菌落总数M
M=
(1.1)
2、目标菌株比例P
P=
(1.2)
式中:
n为平板上菌落数(个),以出现30-300个菌落的平板计数为宜,0.1为涂布稀释液加量(mL),10为量取的增殖培养液量(mL),m为变色菌落数,N为所计数平板的稀释倍数。
3、显微观察典型目标菌落及细胞形态。
实验二蛋白酶生产菌种的筛选
【实验材料】
1.待选菌种
取“实验1”分离出的待选菌株3~5株,或以枯草芽孢杆菌(Bacillussubtilis)和地衣芽孢杆菌(Bacilluslichenifornis)等不同产蛋白酶性状的菌株5~7株。
2.培养基
(1)鉴别培养基:
酪蛋白10g/L,Na2HPO46g/L,KH2PO43g/L,NaCl0.5g/L,NH4Cl1g/L,FeSO40.025g/L,酵母膏0.2g/L,MgSO40.24g/L,CaCl20.011g/L,溴百里酚蓝0.05g/L,琼脂20g/L,pH7.0~7.2,0.1MPa,灭菌20min。
(2)验证培养基:
可溶性淀粉10g/L,蛋白胨5g/L,酵母膏0.25g/L,KH2PO43g/L,NaCl0.5g/L,MgSO40.24g/L,pH7.0~7.2,分装成50mL培养基/250mL三角瓶,0.1MPa,灭菌20min。
3.实验器材
游标卡尺、无菌移液管、无菌培养皿、三角瓶、吸管和涂布棒等。
4.实验设备
恒温水浴锅、涡旋振荡器、超净工作台、高压蒸汽灭菌锅、恒温培养箱、振荡培养箱、紫外可见分光光度计、显微镜等。
1.倒平板
将已经灭菌的鉴别培养基自然冷却至50℃左右(即未凝固之前。
可以将装有融化状态培养基的三角瓶放在50℃恒温水浴锅中保持。
注意倒平板时培养温度过高,培养皿盖上易产生较多的冷凝水,影响菌落形成的自然形态),在超净工作台上无菌操作倒平板,培养基凝固后待用。
2.点种接种
无菌操作用接种环从待选菌株斜面上取一环菌苔点种在鉴别培养基平板上,每平板上选取分布合适的三个点以点种接种方式接入菌体,在平板培养皿上标记各菌株代号。
不同菌株分别接种在不同平板上,各菌株分别做3组平行试验。
3.培养
接种后的平板置于30~32℃下恒温培养箱中培养36h。
4.变色圈测量
分别在培养12h、24h和36h时用游标卡尺从平板培养皿背面分别测定各菌的变色圈直径(mm)与菌落直径(mm),计算其直径比值。
5.验证性培养
选取变色圈直径与菌落直径比值最大的菌株与最小的菌株用接种环分别接入2环菌体于验证液体培养基中,30~32℃,180r/min振荡培养箱中摇瓶培养48h,将发酵液过滤或离心,取清夜检测其中的蛋白酶产量(U)。
6.蛋白酶活力测定
参照附件Ⅸ“蛋白酶活力测定方法”。
1、蛋白酶生产菌种的筛选
表1-1蛋白酶生产菌种的筛选
培养时间
平均直径
菌株1
菌株2
菌株3
菌株4
菌株5
12h
变色圈直径/mm
菌落直径/mm
直径比值
24h
36h
平均变色速率/(mm/h)
注:
平均变色速率为单位时间内菌落周围蓝色变色圈直径增加的程度,用mm/h表示。
2、筛选菌株产酶活性
表1-2菌株产蛋白酶结果验证
菌株编号
培养液
(mL)
24h酶浓度
(U/mL)
36h酶浓度
对照菌株
总酶活(U)
高产菌株
总酶活(U)=培养液中酶浓度(U/mL)×
培养液总体积(mL)。
实验二十一发酵菌种制备
1、菌种
实验选育产蛋白酶菌株,或枯草芽孢杆菌等其它产蛋白酶菌株。
(1)斜面培养基:
牛肉膏蛋白胨琼脂培养基(配方参照附录六“常用培养基”)
(2)种子培养基:
可溶性淀粉5g/L,牛肉膏5g/L,蛋白胨10g/L,NaCl5g/L,0.1MPa,灭菌20min。
三角瓶、容量瓶、吸管(1mL,5mL,25mL)、烘箱、试管架。
5、实验仪器
超净工作台、恒温培养箱、振荡培养箱、高压蒸汽灭菌器、显微镜、分光光度计等。
1、菌种活化
将实验菌种转接到牛肉膏蛋白胨琼脂培养基平板上,37℃倒置培养22~24h活化。
2、接种培养
将活化菌种无菌操作接入装入50mL种子培养基/250mL三角瓶中,每瓶接2环菌苔。
接种后的培养液用蜗旋振荡均匀,32℃,180r/min摇瓶培养18~22h,作为一级种子。
将一级种子按20%的接种量接入250mL种子培养基/1000mL三角瓶中,32℃,150r/min摇瓶培养16~18h,作为二级种子。
3、种子质量检查
培养后的种子培养液无菌操作取样5mL,分别作显微镜涂片染色检验细胞形态,测定培养中的菌体浓度(OD600)和蛋白酶浓度(U/mL)。
4、检测方法
菌体浓度和蛋白酶含量检测参照附录九“菌体浓度检测方法”和“蛋白酶含量测定方法”。
1、种子液中菌种细胞形态图。
2、种子质量指标
表1种子质量指标
检测项目
实测值
参考指标
备注
菌体浓度(OD600)
净增加值>
1.0
产物浓度(U/mL)
<
10
菌体形态
短杆菌,芽孢形成率60-70