人教版版九年级二模下学期期中化学试题B卷Word下载.docx
《人教版版九年级二模下学期期中化学试题B卷Word下载.docx》由会员分享,可在线阅读,更多相关《人教版版九年级二模下学期期中化学试题B卷Word下载.docx(10页珍藏版)》请在冰豆网上搜索。
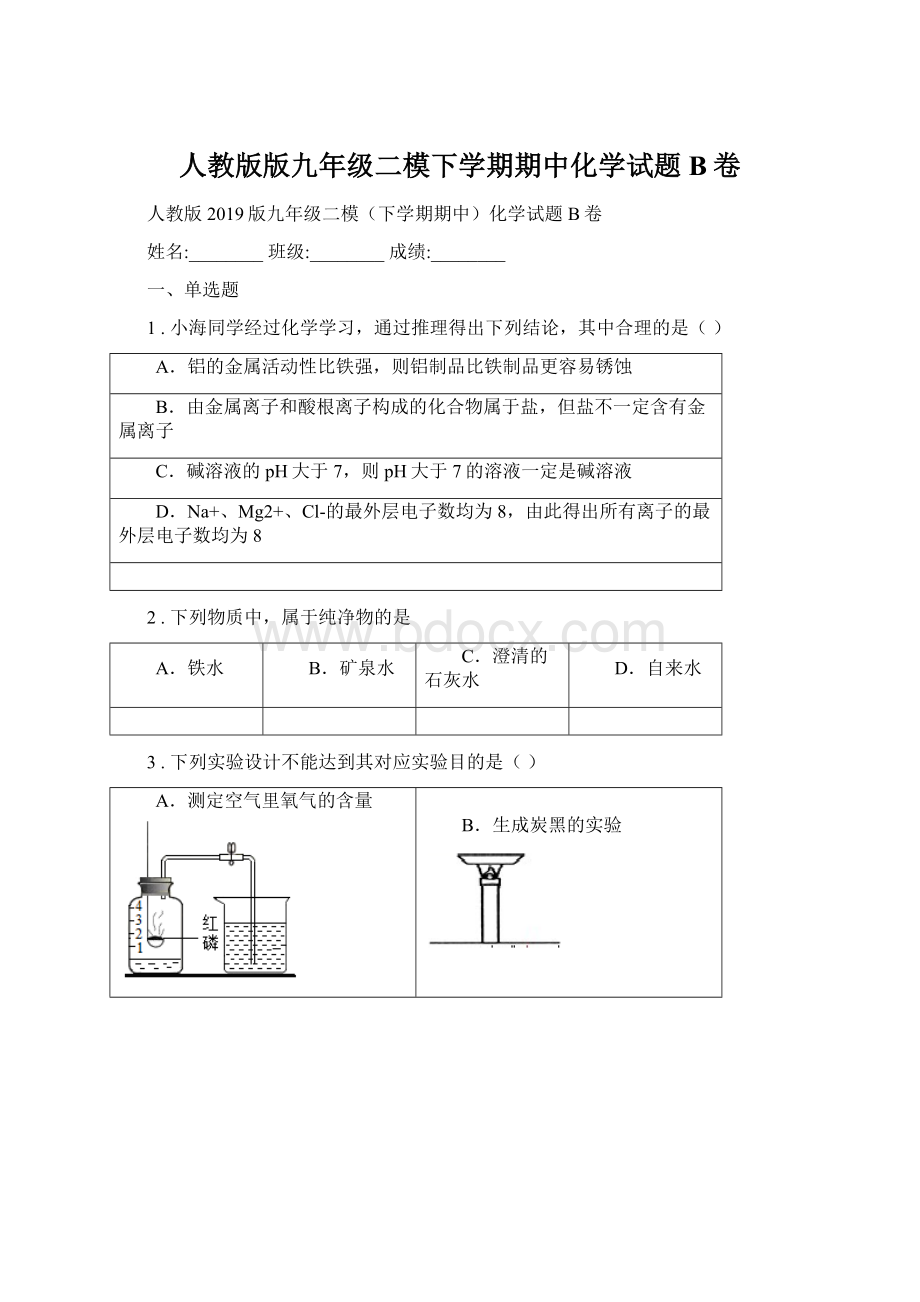
C.验证质量守恒定律
D.比较空气与人体呼出的气体中CO2含量
4.物质的变化是多种多样的,其中属于化学变化的是
A.海水晒盐
B.瓦斯爆炸
C.瓷碗破碎
D.轮胎爆炸
5.下列对有关事实的解释中,正确的是()
A.石墨和金刚石物理性质不同——碳原子结构不同
B.一氧化碳和二氧化碳的化学性质不同——分子构成不同
C.物体受热时体积膨胀——受热时物质的分子变大
D.高锰酸钾受热反应后剩余固体质量变小——该反应不遵守质量守恒定律
6.下列溶液中离子可大量共存的是
A.K+、Mg2+、SO42﹣、OH﹣
B.Na+、H+、NO3﹣、CO32﹣
C.Ba2+、NO3﹣、Cl﹣、SO42﹣
D.NH4+、Cl﹣、NO3﹣、SO42﹣
7.下列四种基本反应类型中,可能没有化合物生成的是()
A.置换反应
B.化合反应
C.分解反应
D.复分解反应
8.下列实验操作中,正确的是()
A.加热试管中的液体
B.用橡胶塞住试管
C.向试管中滴加液体
D.向试管中倾倒液体
9.X、Y、Z有如图所示的转化(“→”表示反应一步实现,部分物质和反应条件已略去),则符合要求的X、Y、Z依次为
A.
B.
C.
D.
10.下列关于饱和溶液的说法,正确的是
A.饱和溶液一定是溶剂质量为100g的溶液
B.某物质的饱和溶液一定比它的不饱和溶液浓
C.饱和溶液降温析出晶体后,剩余溶液可能不饱和
D.浓溶液不一定是饱和溶液,稀溶液不一定是不饱和溶液
11.华为公司最新芯片概解980处理器的应用,摆脱了对国外产品的依赖。
芯片的主要部件半导体硅元件生产中,常用氢氟酸(HF)来消除硅表面的氧化膜,反应原理可表示为SiO2+6HF=H2SiFn+2H2O,n的值是
A.2
B.4
C.6
D.8
12.聚合氯化铝(PAC)的化学式为[Al2(OH)nCl6-n]m,是一种无机高分子混凝剂。
制备时涉及如下反应:
Al(OH)3与[Al(OH)2(H2O)4]Cl反应生成H2O和Al2(OH)nCl6-n,则该反应中两种反应物的计量数之比为
A.1:
1
B.
13.能一次区分稀硫酸、NaOH溶液、NaCl溶液的试剂是
A.酚酞溶液
B.石蕊溶液
C.澄清石灰水
D.稀盐酸
14.下列有关实验操作正确的是()
A.实验室制取气体时,应先检查装置的气密性,再加入药品
B.稀释浓硫酸时,将水沿内壁注入盛有浓硫酸的烧杯中
C.做硫在氧气中燃烧的实验时,在集气瓶底部放少量细沙
D.用pH试纸测定某溶液的pH时,应先用蒸馏水将pH试纸润湿
15.推理是学习化学的一种重要方法,以下类推正确的是()
A.由同种分子构成的物质一定是纯净物,所以纯净物一定是由同种分子构成的
B.中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
C.碳酸盐与稀盐酸反应生成气体,所以与稀盐酸反应生成气体的物质一定是碳酸盐
D.高温或加热时能夺取氧化物中氧的物质可用作还原剂,所以一氧化碳和氢气是常用的还原剂
16.如图是某化学反应的微观示意图,下列说法错误的是()
A.反应前和反应后的物质均为混合物
B.参加反应的分子个数比为3:
2
C.反应前后原子的种类、数目不变
D.生成物中含有碳元素、氢元素和氧元素
17.关于H2、H2O2、H2SiO3三种物质的叙述中,正确的是
A.都含有两个氢原子
B.都含有氢元素
C.都是化合物
D.都含有一个氢分子
18.下列气体中,既能用固体氢氧化钠干燥,又能用浓硫酸干燥的是()
A.二氧化碳
B.二氧化硫
C.氢气
D.氯化氢
19.下列有关化学方程式的书写正确的是()
A.Mg+O2MgO2
B.C+2CuO2Cu+CO2↑
C.KMnO4K2MnO4+MnO2+O2↑
D.2Fe+3H2SO4=Fe2(SO4)3+3H2↑
20.下列各组物质,按混合物、化合物顺序排列的是
A.海水、碳酸钠
B.冰水、水银
C.酱油、硫磺
D.液氮、氖气
二、填空题
21.下图为某化学反应的微观示意图.
回答下列问题:
(1)该反应中________(填“有”或“没有”)单质生成。
(2)该反应中化合价降低的元素是___________。
(3)写出该反应的化学方程式______________________________其反应的类型________。
(4)参加反应的氧化物与生成的氧化物的质量比为____________。
三、简答题
22.温州产盐历史悠久,盐产品在日常生活、工业生产中有广泛用途。
(1)用下图方法可进行粗盐提纯,其中操作②的名称为
。
(2)海水晒盐过程中,还能得到氯化镁(MgCl2)。
工业上利用氯化镁在通电条件下分解,获得镁和氯气(Cl2)。
写出这一反应的化学方程式:
(3)腌制咸鸭蛋需要合适溶质质量分数的食盐水。
现有10千克溶质质量分数为25%的食盐水,若将其稀释到20%,需加水多少千克?
四、流程题
23.高纯氧化铁又称“引火铁”,可作催化剂,在现代工业上有广泛应用前景。
以下是用赤铁矿(含少量不溶于水的SiO2等)为原料,制备高纯氧化铁的生产流程示意图。
查阅信息:
(NH4)2CO3溶液呈碱性,40℃以上易分解。
(1)写出高温时赤铁矿中的Fe2O3与CO发生反应的化学方程式_____。
(2)①处发生反应的化学方程式为_____。
(3)加入(NH4)2CO3后,该反应必须控制的条件是____。
(4)加适量氨水的目的是____,以确保加入的(NH4)2CO3能顺利发生复分解反应而生成FeCO3,则②处反应的化学方程式为_____。
(5)用蒸馏水洗涤FeCO3的目的是除去表面附着的杂质,洗涤干净的标志是:
取最后一次洗涤液,向其中加入适量的____
五、科学探究题
24.某研究性学习小组对中和反应进行探究,请你参与实验
(探究活动1)证明酸和碱发生了反应
小丽同学按图1进行实验,证明了盐酸和NaOH溶液能发生化学反应,他依据的实验现象是____;
反应的化学方程式____。
(探究活动2)能否通过证明有水生成来证明其反应的发生?
(设计实验)小明同学取变色硅胶、无水醋酸和氢氧化钠固体进行如图2所示的三个实验.
(小资料)a.变色硅胶吸水后由蓝色变为红色;
b.无水醋酸是一种酸,常温下为无色液体;
(1)实验①、②的实验目的是____;
(2)加入试剂后,要迅速塞紧橡胶塞的原因是____;
(3)能证明酸和碱反应有水生成的现象是_____;
(4)除了上述方法之外,还可以按照下表实验方法证明稀盐酸与氢氧化钠发生了反应,说出对应的实验现象和实验结论:
实验步骤
实验现象
实验结论
取少量氢氧化钠溶液于试管中,加入过量稀盐酸,再加入少量氧化铜
_____
氢氧化钠和盐酸发生了反应
25.天然气的主要成分是甲烷(CH4),小茗同学所在的化学兴趣小组对甲完燃烧的产物产生了兴趣,请你参与:
(提出问题):
甲烷燃烧后生成哪些物质?
(查阅资料):
含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;
CuO是一种黑色粉末,无水CuSO4遇水变蓝。
(猜想与假设):
甲:
CO2和H2O;
乙:
CO和H2O;
丙:
NH3、CO2和H2O;
丁:
CO2、CO和H2O。
你认为_____________同学的猜想是错误的,理由是___________。
(实验探究):
为了验证上述猜想与假设,将甲烷在一定量的O2中燃烧的产物依次通过下列装置:
(1)A、B装置的顺序能否顺倒?
(填“能“或“否”)________。
(2)实验中观察到A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中黑色粉末变成红色,由此推断______同学猜想成立。
请写出C中反应的化学方程式:
____________。
(反思与交流):
(1)为避免有毒的CO污染环境,所以含碳元素的物质燃烧必须满足的条件是___________。
(2)含碳物质的燃烧因条件不同,产物常是混合物,故实验室常采用大理石和盐酸反应制取比较纯净的二氧化碳,该反应化学方程式为________________。
六、计算题
26.把含有铜粉的干燥氧化铜粉末共42g,放入玻璃管中通入一氧化碳并加热,待氧化铜反应完全后,冷却称重,得到铜粉为35.6g,求原混合物中氧化铜的质量分数。
参考答案
1、
2、
3、
4、
5、
6、
7、
8、
9、
10、
11、
12、
13、
14、
15、
16、
17、
18、
19、
20、