中考化学流程题题含答案Word文件下载.docx
《中考化学流程题题含答案Word文件下载.docx》由会员分享,可在线阅读,更多相关《中考化学流程题题含答案Word文件下载.docx(17页珍藏版)》请在冰豆网上搜索。
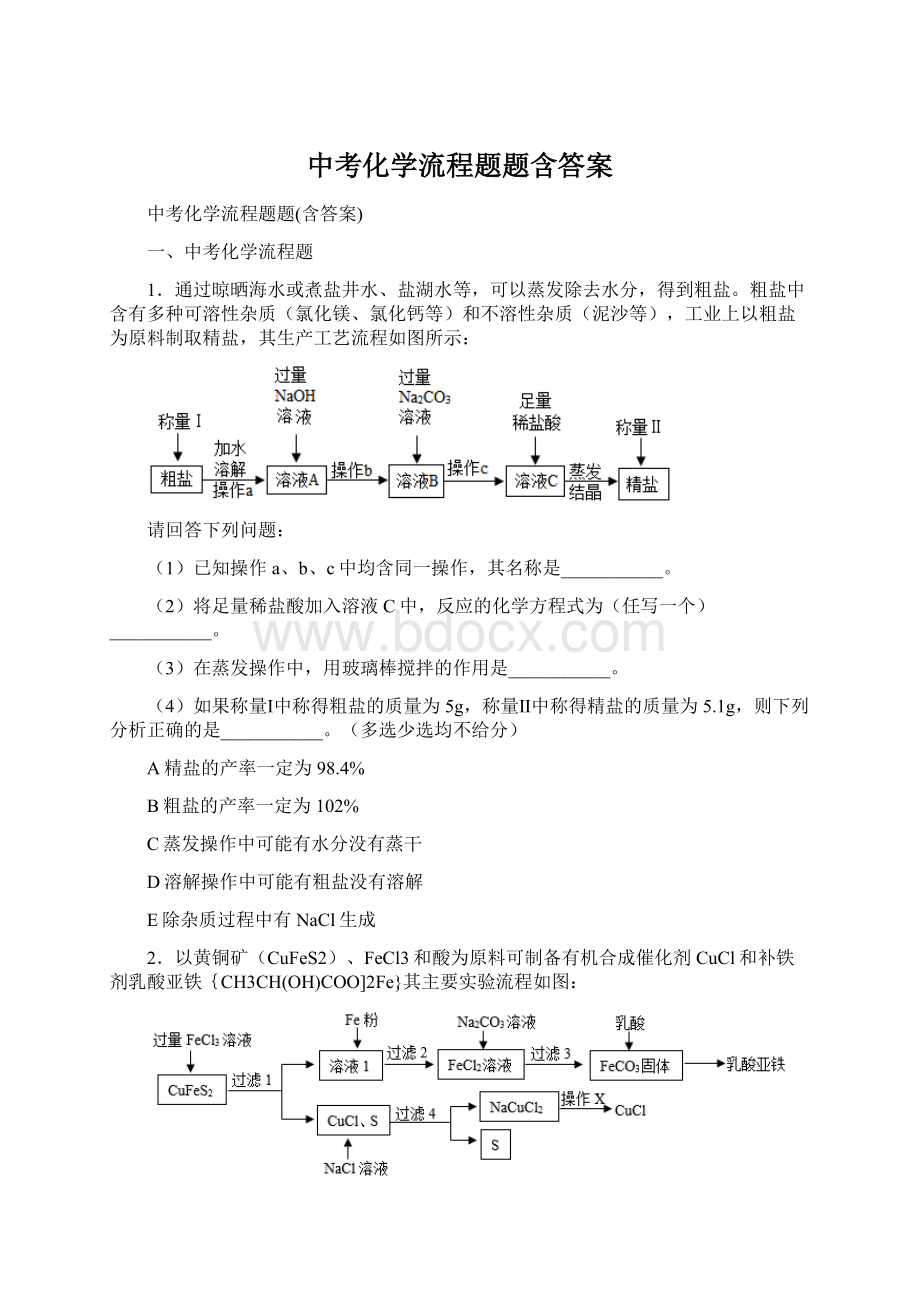
(查阅资料)
(1)FeCl3溶液加入CuFeS2的反应方程式为。
(2)乳酸亚铁是一种有机物,绿白色粉末或晶体,在空气中容易被氧化。
(3)CuCl为白色晶体,难溶于水和乙醇,在空气中容易被氧化。
CuCl可与NaCl溶液反应生成易溶于水的NaCuCl2,其反应方程式为,NaCuCl2在一定条件下可与水反应生成CuCl。
回答下列题:
(1)实验室过滤需用到的玻璃仪器有:
烧杯、玻璃棒和______。
(2)溶液1中加入铁粉的目的是为了除去过量的FeCl3,发生反应的化学反应方程式为______。
(3)向FeCl2溶液中加入Na2CO3溶液所得的混合体系为______。
A溶液B悬浊液C乳浊液
(4)乳酸亚铁中C、H元素质量比为______;
实验室制备乳酸亚铁的装置如图所示,实验前先通入N2的目的是______。
(5)NaCuCl2与水反应时,温度对CuCl产率的影响如图所示。
则由CuCl、S混合物提纯CuCl时,先将一定量的混合物溶于饱和NaCl溶液中,过滤,控制滤液温度______℃左右,调节滤液的酸度,搅拌、______过滤,用乙醇洗净所得固体,置于真空干燥箱中干燥。
3.现有含NaCl、Na2SO4、NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl﹣、、的相互分离。
相应的实验过程可用下列流程图表示:
(1)写出上述实验过程中所用试剂、沉淀的化学式:
试剂1:
___________沉淀C:
___________
(2)写出溶液a中所含有的阳离子___________;
(3)恰当地控制试剂4的加入量的方法是___________。
4.高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。
以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
(1)软锰矿和氢氧化钾按一定比例在“烘炒锅”中混合,在“平炉”中与氧气发生化学反应,反应后生成K2MnO4和一种相对分子质量最小的氧化物。
该反应的化学方程式为___________。
(2)将K2MnO4转化为KMnO4的生产有两种工艺:
①“CO2歧化法”是传统工艺,即在K2MnO4水溶液中通入CO2气体,反应生成KMnO4,MnO2和另一种物质。
该物质可能为___________。
ANa2CO3BKHCO3CK2O
②“电解法”为现代工艺,即电解K2MnO4水溶液,生成高锰酸钾、氢氧化钾的同时还生成一种密度最小的气体。
5.空气是宝贵的自然资源。
如图是以空气等为原料合成尿素的流程(部分产物略)。
(1)空气属于______(填“纯净物”或“混合物”)。
工业上获取氧气主要通过分离液态空气法,通过控制温度先分离出N2,可见N2的沸点______(填“>
”“<
”或“=”)O2的沸点,该过程属于______(填“物理”或“化学”)变化。
(2)X气体在空气中的体积分数约为0.03%,则该气体的构成微粒是______(填化学符号),X气体是否具有毒性______(填“是”或“否”)。
经反应①,含碳物质中的碳元素若完全转化至气体X中,则该反应表示的是含碳物质的______(填“完全”或“不完全”)燃烧,请写出X气体的一种用途______。
(3)反应②生成尿素CO(NH2)2的同时还生成相对分子质量最小的氧化物,请写出该反应的化学方程式______。
6.氧化锌(ZnO)可作为紫外线吸收剂应用于化妆品中其一种生产工艺如下
(1)写出草酸铵中所含的原子团_____、_____。
(2)请补全“沉锌过程中发生反应的化学方程式ZnCl2+_____=_____↓+2NH4Cl。
(3)“操作A”的名称是_____。
(4)“高温灼烧时草酸锌分解,预测可能生成的气体混合物:
猜想1:
CO和O2猜想2:
CO2和O2猜想3:
CO和CO2
预测的依据是:
_____。
其中猜想
(1)一定错误,因为_____(写出化学方程式进行解释)。
请根据猜想3,书写草酸锌分解的化学方程式_____。
7.人类的生活和工农业生产都离不开水,如图是自来水厂净水过程示意图。
回答下列问题:
(1)天然水如海水中溶解了大量的氯化钠,构成氯化钠的粒子是________________。
(2)絮凝反应处理中加入氯化铁处理微小悬浮物,氯化铁的化学式是________________。
(3)有用户反映自来水有黄色浑浊物,你认为是自来水厂的哪个操作不合规范________________。
(4)下图是某反应的微观示意图:
①请把图中A和B的反应物的微观示意图补画齐全_______________。
②C框中的物质属于________________(填序号:
①化合物、②单质、③纯净物、④混合物)
③该反应的化学方程式为______________________。
8.工业上以空气、煤等为原料经过一定步骤合成尿素[CO(NH2)2]的流程图(部分产物已略去)。
第一步:
分离空气分离空气的常用方法有以下两种:
方法Ⅰ.将空气液化后再气化。
①液态空气气化时首先分离出氮气,则沸点:
N2________O2(选填“高于”、“等于”、“低于”)。
在此过程中,氧分子和氮分子_________改变(选填“发生”或“不发生”)。
此分离空气法属于_________变化(填“物理”或“化学”)。
方法Ⅱ.用碳分子筛分离。
资料:
1、碳分子筛对不同气体的吸附强度不同,由于氧分子通过碳分子筛微孔系统的狭窄空隙的扩散速度比氮分子快得多。
因此,当加压时它对氧优先吸附。
2、气压越大,碳分子筛吸附能力越强,反之越弱。
3、碳分子筛可以再生,能重复使用。
②碳分子筛是一种内部分布有均匀微小孔径的固体,通过特制的分子筛把空气中的氧分子吸入孔穴而与其它分子分离,则分子大小:
N2________O2(选填“大于”、“等于”、“小于”)。
③根据资料,碳分子筛再生的方法是__________。
第二步:
合成尿素:
④根据流程图写出利用NH3合成尿素和水的符号表达式:
___________。
⑤上述过程生产的尿素样品标签如下图,则该尿素样品中氮元素的质量为________kg(结果保留至0.1)。
此尿素样品__________纯净的尿素(选填是或不是)。
9.我国海洋资源丰富。
如图是从海水中获得一些资源的简易流程图。
(粗盐提纯)除去难溶性杂质后的食盐水中还含有杂质(CaCl2、MgCl2、Na2SO4),得到较纯的氯化钠,进行如下的流程的实验操作。
(1)第②③步操作中需要的试剂可以用一种试剂替代,此试剂是_____(填化学式)
(2)在实验室第⑤步操作中需要用到的玻璃仪器有_______、玻璃棒和烧杯,其中玻璃棒的作用是
__________。
(3)第⑥步操作中,加入适量盐酸的目的是________。
(海水制碱)工业上电解饱和食盐水能获得烧碱、氯气和另一种可燃性气体
(4)配置氯化钠饱和溶液。
已知常温下氯化钠溶解度为36.0g,现要将125g、20%的氯化钠溶液配成饱和溶液,仅需加氯化钠_____g;
配好的溶液溶质质量分数为____(精确到0.1%)
(5)写出电解饱和食盐水的化学反应方程式_____________。
10.利用海水(含NaCl、MgCl2)制取NaOH溶液,用来处理含SO2的废气,同时得到副产品盐酸的实验流程如下图:
(部分反应物、生成物和反应条件已省略)
(1)沉淀B的成分为_____________(填名称),沉淀B需用蒸馏水多次洗涤,为了检验沉淀B是否洗涤干净,可向最后一次洗涤液中加入某些试剂,下列方案可行的是_______(填序号);
A稀硝酸
BNa2CO3溶液
C氯化钠
DAgNO3和HNO3混合溶液
(2)反应②中反应物除了NaC1外,还有_______________(填化学式):
下列有关电解后溶液的说法正确的是_____________(填序号)。
A溶液的pH增大
B一定为氢氧化钠的饱和溶液
C溶液中钠元素的质量分数不变
(3)若将所得盐酸加入Na2SO3溶液中,可生成氯化钠、水和二氧化硫,则该反应的基本反应类型属于_____________。
已知:
H2SO3与H2CO3的化学性质相似,都易分解。
11.某矿石主要成分是MgO,含少量的Fe2O3、CuO和SiO2杂质。
用该矿石制备Mg(OH)2的工艺流程简图如图所示:
(1)步骤①和步骤②均用到的操作是_________________,该操作中用到的玻璃棒的作用是_______。
(2)溶液A中所含的阳离子有Fe3+、Cu2+、Mg2+和_________(填离子符号)。
步骤①中发生反应的化学方程式是(只要求写出一个)_______________。
(3)已知部分金属阳离子以氢氧化物形成沉淀时溶液的pH见下表:
对应离子
Fe3+
Cu2+
Mg2+
开始沉淀时的pH
1.9
4.2
9.1
完全沉淀时的pH
3.2
6.7
11.1
步骤②加入熟石灰,调节溶液的pH范围为_______________,固体C中所含成分的化学式为___________。
(4)步骤③中制得Mg(OH)2的化学方程式为_____。
在医药上,氢氧化镁可用来____。
12.氢氧化镁是一种重要的化工原料。
某矿石由MgO、Fe2O3、CuO和SiO2组成,用它制备氢氧化镁的流程示意图如图。
部分金属阳离子以氢氧化物形式形成沉淀时溶液的pH见下表。
沉淀物
Fe(OH)3
Cu(OH)2
Mg(OH)2
开始沉淀
完全沉淀
(1)图中操作Ⅰ和Ⅱ的名称是_____。
(2)溶液A中的阳离子是_____(填离子符号)。
(3)在溶液A中加入熟石灰后控制pH为7﹣9的目的是_____。
(4)溶液B与熟石灰反应的化学方程式是_____。
【参考答案】***试卷处理标记,请不要删除
1.过滤NaOH+HCl=NaCl+H2O(或Na2CO3+2HCl=2NaCl+CO2↑+H2O使液体受热均匀(或防止液体外溅)CE
【详解】
(1)操作a、b、c中均
解析:
过滤NaOH+HCl=NaCl+H2O(或Na2CO3+2HCl=2NaCl+CO2↑+H2O使液体受热均匀(或防止液体外溅)CE
(1)操作a、b、c中均有分离沉淀和溶液的操作,即