高考化学原创押题卷二Word文档格式.docx
《高考化学原创押题卷二Word文档格式.docx》由会员分享,可在线阅读,更多相关《高考化学原创押题卷二Word文档格式.docx(14页珍藏版)》请在冰豆网上搜索。
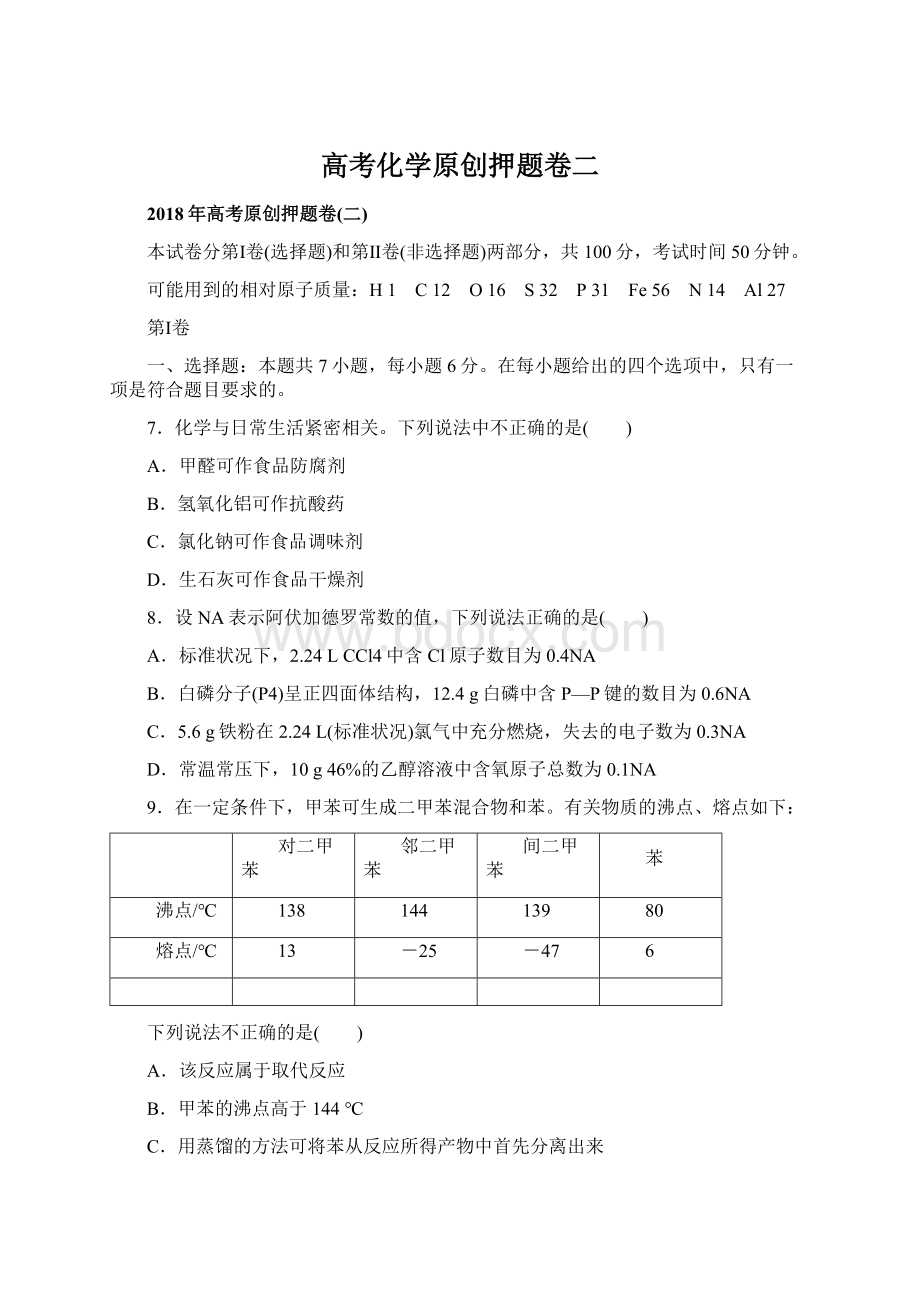
9.在一定条件下,甲苯可生成二甲苯混合物和苯。
有关物质的沸点、熔点如下:
对二甲苯
邻二甲苯
间二甲苯
苯
沸点/℃
138
144
139
80
熔点/℃
13
-25
-47
6
下列说法不正确的是( )
A.该反应属于取代反应
B.甲苯的沸点高于144℃
C.用蒸馏的方法可将苯从反应所得产物中首先分离出来
D.从二甲苯混合物中,用冷却结晶的方法可将对二甲苯分离出来
10.仅用下表提供的仪器和药品,就能达到相应实验目的的是( )
编号
仪器
药品
实验目的
A
托盘天平(带砝码)、胶头滴管、量筒、烧杯、药匙、玻璃棒
NaCl固体、蒸馏水
配制一定质量分数的NaCl溶液
B
分液漏斗、烧瓶、锥形瓶、导管及橡皮塞
盐酸、大理石、硅酸钠溶液
证明非金属性:
Cl>
C>
Si
C
酸式滴定管、胶头滴管、铁架台(带铁夹)
已知浓度的盐酸、待测NaOH溶液
测定NaOH溶液的物质的量浓度
D
烧杯、分液漏斗、胶头滴管、铁架台
待提纯的AlCl3溶液、NaOH溶液
提纯混有MgCl2杂质
的AlCl3溶液
11.短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )
X
Y
Z
W
A.原子半径:
W>
Z>
Y>
B.最高价氧化物对应水化物的酸性:
X>
C.最简单气态氢化物的热稳定性:
D.元素X、Z、W的最高化合价分别与其主族序数相等
12.某澄清、透明的浅黄色溶液中,可能含有下列八种离子:
Na+、NH
、Fe3+、Ba2+、Al3+、SO
、HCO
、I-,在设计检验方案前的初步分析中,可确定该溶液中能大量存在的离子最多有( )
A.4种 B.5种
C.6种 D.7种
13.装置(Ⅰ)为铁镍(Fe�Ni)可充电电池:
Fe+Ni2O3+3H2O
Fe(OH)2+2Ni(OH)2;
装置(Ⅱ)为电解示意图。
当闭合开关K时,电极Y附近溶液先变红。
下列说法正确的是( )
A.闭合K时,电极X的反应式为2H++2e-===H2↑
B.闭合K时,电极A的反应式为Ni2O3+2e-+2H++H2O===2Ni(OH)2
C.给装置(Ⅰ)充电时,电极B上参与反应的物质被氧化
D.给装置(Ⅰ)充电时,OH-通过阴离子交换膜移向电极A
第Ⅱ卷
二、非选择题:
本题包括必考题和选考题两部分。
第26题~28题为必考题,每个试题考生都必须做答。
第37题~38题为选考题,考生根据要求作答。
(一)必考题(43分)
26.(14分)辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。
一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示:
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:
____________________________________
(2)“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是_________________________
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为_____________________________________________
向“滤液M”中加入(或通入)________(填字母),可得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)“保温除铁”过程中,加入CuO的目的是____________________________________________
“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由是__________________________________________________________________
27.(14分)氮元素能形成多种多样的化合物。
请回答:
(1)298K时,在2L固定体积的密闭容器中,发生可逆反应:
2NO2(g)N2O4(g) ΔH=-akJ/mol(a>
0)。
N2O4的物质的量浓度随时间变化如图甲。
达到平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
甲
①298K时,该反应的平衡常数为________(精确到0.01)。
②下列情况不能用来判断该反应是否处于平衡状态的是________(填字母代号)。
A.混合气体的密度保持不变B.混合气体的颜色不再变化
C.混合气体的气体压强保持不变
③若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时v(正)________v(逆)(填“>
”“<
”或“=”)。
乙
(2)常温条件下,向100mL0.1mol·
L-1NH4HSO4溶液中滴加0.1mol·
L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图乙所示。
试分析图中a、b、c、d、e五个点(该条件下硫酸第二步电离是完全的)。
①a点溶液的pH________1(填“>
②b点溶液中发生水解反应的离子是________。
③c点溶液中各离子浓度由大到小的排列顺序为________。
④d、e点对应溶液中,水电离程度大小关系是d________e(填“>
28.(15分)焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,是黄色晶体。
实验室可利用二氧化硫与亚硫酸钠反应制备焦亚硫酸钠。
某研究小组进行如下实验:
实验一:
焦亚硫酸钠的制取
采用如图装置(实验前已除尽装置内的空气)制取Na2S2O5,装置Ⅱ中有黄色晶体析出。
(1)装置Ⅰ中产生气体的化学方程式为_______________________________
______________________________________________________________。
(2)要从装置Ⅱ中获得已析出的晶体,在实验室中需要用到的玻璃仪器是_________________________
(3)装置Ⅲ用于处理尾气,防止污染环境。
下列装置中,可选用的最合理装置(夹持仪器已略去)为________(填序号)。
实验二:
焦亚硫酸钠的性质
(4)检验Na2S2O5晶体在空气中已被氧化的实验方案是
_________________________________________________________________
实验三:
葡萄酒中抗氧化剂残留量的测定
(5)葡萄酒常用Na2S2O5作抗氧化剂。
测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
葡萄酒样品100.00mL
馏分
溶液出现蓝色且30s内不褪色
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为________g·
L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果________(填“偏高”“偏低”或“不变”)。
(二)选考题:
共15分。
请考生从两道题中任选一题作答。
如果多做,则按第一题计分。
37.[选修3:
物质结构与性质](15分)铝及其化合物在工农业生产及日常生活中有重要用途。
请回答下列问题:
(1)Al原子的价电子排布图为_________________________________,
Na、Mg、Al的第一电离能由小到大的顺序为________________________。
(2)某含有铝元素的翡翠的化学式为Be3Al2(Si6O18),其中Si原子的杂化轨道类型为________。
(3)
工业上用氧化铝、氮气、碳单质在高温条件下可制备一种四面体结构单元的高温结构陶瓷,其晶胞如图所示:
①该制备反应的化学方程式为_____________________________________。
②该化合物的晶体类型为________,该晶胞中有________个铝原子,该晶胞的边长为apm,则该晶胞的密度为________g·
cm-3。
(4)
AlCl3的相对分子质量为133.5,183℃开始升华,易溶于水、乙醚等,其二聚物(Al2Cl6)的结构如图所示,图中1键键长为206pm,2键键长为221pm,从键的形成角度分析1键和2键的区别:
________________________________
(5)LiAlH4是一种特殊的还原剂,可将羧酸直接还原成醇:
CH3COOH
CH3CH2OH
CH3COOH分子中π键和σ键的数目之比为________,分子中键角α________键角β(填“大于”、“等于”或“小于”)。
38.[选修5:
有机化学基础](15分)松油醇(G)可用于配制香精,其合成路线如下:
(1)G所含两种官能团的名称分别是______________________________、
____________________。
(2)同时符合下列两个条件的B的同分异构体有________种。
ⅰ.含有六元碳环,碳环上仅有两个取代基且呈对位;
ⅱ.在一定条件下能发生银镜反应、水解反应和消去反应。
(3)为了鉴别E和F,宜选用下列试剂中的________作鉴别试剂(填字母)。
a.溴水b.银氨溶液
c.酸性KMnO4溶液d.NaHCO3溶液
(4)C→D的化学方程式为________________________________________
(5)物质A(分子式为C7H10O3)催化氢化得到H(分子式为C7H12O3),H在一定条件下可以生成高聚物I,I的结构简式为________________________________。
7.A [甲醛为有毒物质,不能用作食品防腐剂。
]
8.B [标准状况下,CCl4为液态,不能根据气体摩尔体积来计算,A项错误;
1个白磷分子中含有6个P—P键,12.4g(0.1mol)白磷中含有P—P键的数目为0.6NA,B项正确;
5.6g铁粉为0.1mol,