高考化学 铁及其化合物推断题综合试题含详细答案.docx
《高考化学 铁及其化合物推断题综合试题含详细答案.docx》由会员分享,可在线阅读,更多相关《高考化学 铁及其化合物推断题综合试题含详细答案.docx(19页珍藏版)》请在冰豆网上搜索。
高考化学铁及其化合物推断题综合试题含详细答案
2020-2021高考化学铁及其化合物推断题综合试题含详细答案
一、铁及其化合物
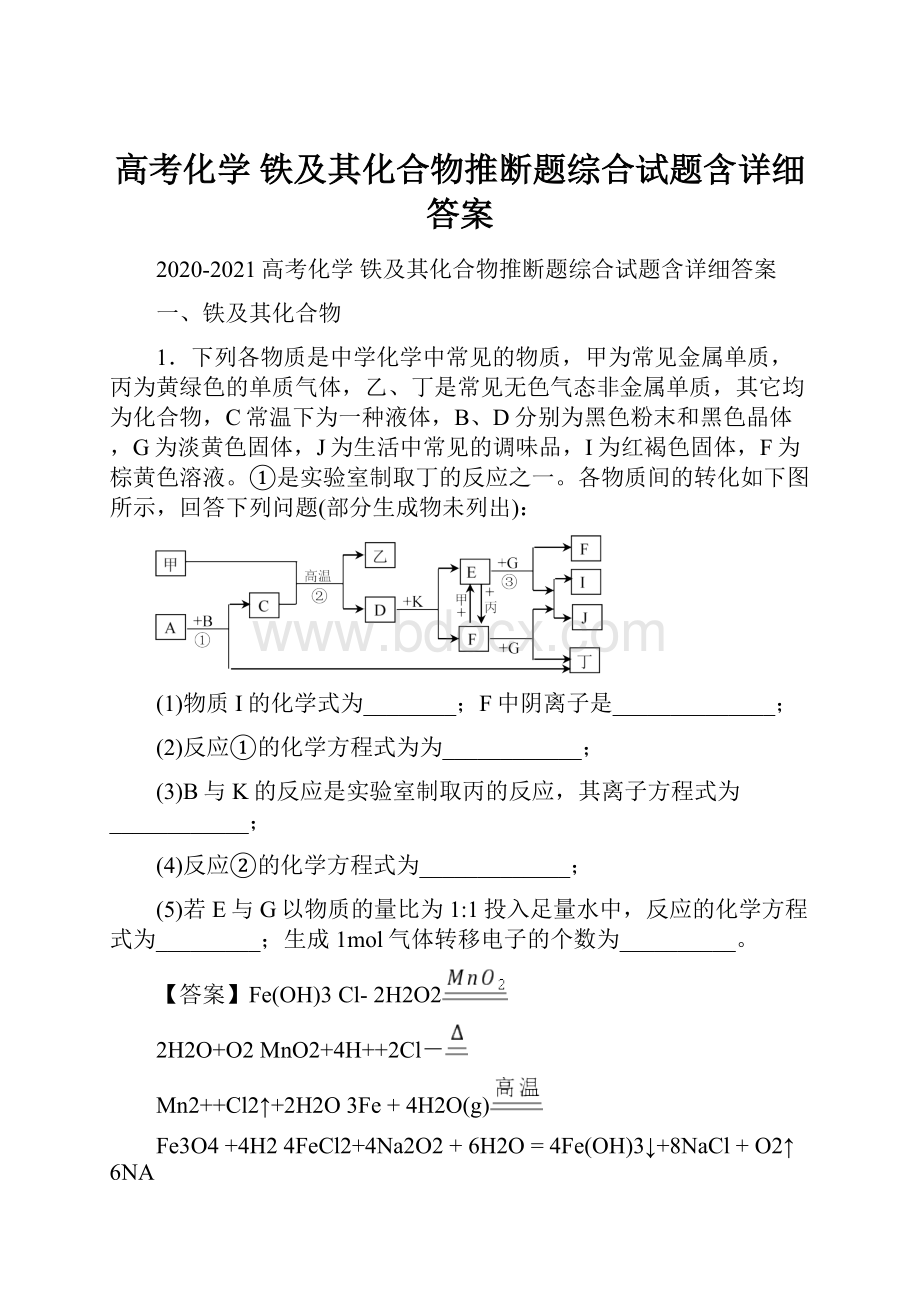
1.下列各物质是中学化学中常见的物质,甲为常见金属单质,丙为黄绿色的单质气体,乙、丁是常见无色气态非金属单质,其它均为化合物,C常温下为一种液体,B、D分别为黑色粉末和黑色晶体,G为淡黄色固体,J为生活中常见的调味品,I为红褐色固体,F为棕黄色溶液。
①是实验室制取丁的反应之一。
各物质间的转化如下图所示,回答下列问题(部分生成物未列出):
(1)物质I的化学式为________;F中阴离子是______________;
(2)反应①的化学方程式为为____________;
(3)B与K的反应是实验室制取丙的反应,其离子方程式为____________;
(4)反应②的化学方程式为_____________;
(5)若E与G以物质的量比为1:
1投入足量水中,反应的化学方程式为_________;生成1mol气体转移电子的个数为__________。
【答案】Fe(OH)3Cl-2H2O2
2H2O+O2MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O3Fe+4H2O(g)
Fe3O4+4H24FeCl2+4Na2O2+6H2O=4Fe(OH)3↓+8NaCl+O2↑6NA
【解析】
【分析】
丙为黄绿色单质气体,所以丙为Cl2,B与K的反应是实验室制取丙的反应,且B为黑色粉末,则B为MnO2,K为HCl;①是实验室制取丁的反应之一,则该反应为双氧水在二氧化锰的催化作用下制取氧气的反应,所以C为H2O,丁为氧气;G为淡黄色固体,且可以生成氧气,则G应为Na2O2,则J为生活中常见的调味品,应为NaCl,I为红褐色固体应为Fe(OH)3;F为棕黄色溶液,应含Fe3+,E与氯气反应可生成F,则F为FeCl3,E为FeCl2;氯化铁可以与单质铁反应生成氯化亚铁,所以甲为铁单质,Fe可以在高温条件下与水反应生成氢气和四氧化三铁,所以乙为氢气,D为Fe3O4。
【详解】
(1)根据分析可知物质I为Fe(OH)3;F中阴离子为Cl-;
(2)反应①为双氧水在二氧化锰的催化作用下制取氧气,方程式为2H2O2
2H2O+O2;
(3)实验室利用浓盐酸和二氧化锰共热制取氯气,方程式为:
MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O;
(4)反应②为Fe在高温条件下与水蒸气反应生成氢气和四氧化三铁的反应,方程式为:
3Fe+4H2O(g)
Fe3O4+4H2;
(5)E为FeCl2,G为Na2O2,过氧化钠有强氧化性可氧化亚铁离子为铁离子,被还原时-1价的氧被还原成-2价,二者1:
1反应,说明氧化产物不止有Fe3+,再联系过氧化钠可以与水反应生成氧气,可知产物中应还有氧气,Na2O2自身发生氧化还原反应,所以E与G以物质的量比为1:
1投入足量水中,反应方程式为4FeCl2+4Na2O2+6H2O=4Fe(OH)3↓+8NaCl+O2↑。
【点睛】
解决此类题目要根据物质的性质、特征作为突破口进行推断,例如本题中“丙为黄绿色单质气体”,则丙为Cl2,“F为棕黄色溶液”,则其溶液中应含有Fe3+,学生平时的学习中要注意多积累一些有特殊性质的物质。
2.利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子并得到副产物ZnO。
制备流程如图所示:
(已知ZnO能溶于强碱)
已知:
Zn及其化合物的性质与Al及其化合物的性质相似。
请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的目的是________(填字母)。
A去除油污B溶解镀锌层
C去除铁锈D钝化铁皮
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是抽滤______。
(3)加适量H2O2目的是________溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是_____。
(4)副产物ZnO常用于制备锌单质。
我国早有炼锌技术的记载,明代宋应星著的《天工开物》中有“升炼倭铅”的记载:
“每炉甘石十斤,装载入一泥罐内……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红冷定毁罐取出…即倭铅也。
”该炼锌工艺过程涉及主要反应的化学方程式为_________,(注:
炉甘石的主要成分为碳酸锌,“倭铅”是指金属锌)。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。
若需配制浓度为0.01mol·L-1的K2Cr2O7标准溶液250mL,应准确称取________gK2Cr2O7[保留4位有效数字,已知Mr(K2Cr2O7)=294]。
配制该标准溶液时,下列仪器中用不到的有________(填编号)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤250mL容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”“偏小”或“不变”)。
【答案】AB洗涤、灼烧将部分亚铁离子氧化成铁离子防止Fe2+被氧化ZnCO3+2C
Zn+3CO↑0.7350③⑦偏大
【解析】
【分析】
【详解】
(1)A.氢氧化钠溶液与油污反应生成高级脂肪酸盐,具有去除油污作用,A符合题意;
B.根据Zn及化合物的性质与Al及化合物的性质相似,Zn也能和氢氧化钠溶液反应,氢氧化钠溶液起到溶解镀锌层,B符合题意;
C.氢氧化钠和铁不反应,C不符合题意;
D.氢氧化钠不能钝化铁皮,故D不符合题意;
答案为:
AB;
(2)调节溶液A的pH可产生Zn(OH)2沉淀,抽滤就可以得到氢氧化锌沉淀,洗涤除去附着的离子,高温灼烧氢氧化锌分解得到ZnO;
(3)Fe3O4中有+3价铁,因此加适量H2O2目的是将部分亚铁离子氧化成铁离子,将亚铁离子和铁离子达到Fe3O4中+2价铁与+3价铁的比例关系,持续通入N2,主要防止Fe2+被氧化;故答案为:
将部分亚铁离子氧化成铁离子;防止Fe2+被氧化;
(4)该炼锌工艺参加反应的物质是煤炭饼和炉甘石(碳酸锌),得到的物质是倭铅(金属锌)和CO,联想初中所学高炉炼铁原理,则炼锌过程涉及主要反应的化学方程式为ZnCO3+2C
Zn+3CO↑;
(5)m(K2Cr2O7)=0.01mol·L-1×0.250L×294g·mol-1=0.7350g,电子天平用于准确称量固体质量,烧杯用于溶解固体,玻璃棒用于搅拌和引流,容量瓶用于配制溶液,胶头滴管用于加水定容。
用不到的仪器为量筒和移液管;故答案为:
0.7350g;③⑦;
(6)如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,滴定结束后气泡消失,这样就造成读出来的K2Cr2O7标准溶液体积偏大,测定结果将偏大。
3.纳米Fe3O4在生物医学和催化剂载体等领域应用前景光明。
其制备流程如下:
已知:
锌单质溶于强碱生成ZnO22-;Zn(OH)2既能溶于强酸又能溶于强碱。
请回答下列问题:
(l)用NaOH溶液处理废旧锌铁皮的作用有___。
A.去除油污B.溶解镀锌层C.去除铁锈D.钝化
(2)步骤②生成Zn(OH)2沉淀的离子方程式为____,用离子方程式结合文字说明该步骤pH不能过小的原因____。
调节pH的最佳方法是向溶液中通入____(填化学式)。
(3)步骤④反应的离子方程式为_____;为确保纳米Fe3O4粒子的纯度,应调整原溶液中Fe2+与所加H2O2的物质的量之比为_______。
(4)步骤⑤制得Fe3O4纳米粒子的过程,需要在无氧环境下进行,说明理由__________;T业生产中可采取___________措施提供无氧环境。
(5)步骤⑤_______(填“能”或“不能”)用减压过滤(抽滤)得到纳米Fe3O4粒子?
理由是___________。
【答案】ABZnO22-+2H+=Zn(OH)2↓加入酸是为了使ZnO22-转化为Zn(OH)2沉淀,但加入酸不能过多,要防止发生Zn(OH)2+2H+=Zn2++2H2O,降低ZnO产量CO22Fe2++H2O2+2H+=2Fe3++2H2O3:
1防止Fe2+[或Fe(OH)2]被氧化持续通入N₂不能纳米粒子太小,抽滤时容易透过滤纸
【解析】
【分析】
根据流程图及已知信息分析得:
废旧镀锌铁皮加入氢氧化钠溶液中反应,锌溶解生成偏锌酸钠和氢气,铁不溶解,过滤得到滤液A为Na2ZnO2,不溶物为Fe,溶液A加稀硫酸使溶液中ZnO22-转化为Zn(OH)2沉淀,再经过过滤、洗涤、干燥,灼烧得到ZnO,不溶物Fe中加入稀盐酸,反应生成氯化亚铁,加入适量H2O2,氧化部分亚铁离子为铁离子,得到含Fe2+、Fe3+的B溶液,再加入NaOH,并通入氮气排除氧气,加热分解,生成四氧化三铁胶体粒子,据此分析解答。
【详解】
(1)氢氧化钠溶液有助于铁皮表面的油污水解除去,同时由题干信息知锌易溶于氢氧化钠溶液,故答案为:
AB;
(2)根据题给信息知,步骤②为ZnO22-与酸反应生成Zn(OH)2的反应,离子方程式为:
ZnO22-+2H+=Zn(OH)2↓;加入酸是为了使ZnO22-转化为Zn(OH)2沉淀,但加入酸不能过多,要防止发生Zn(OH)2+2H+=Zn2++2H2O,降低ZnO产量;所得溶液呈碱性,为了不引入新的杂质,调节pH的最佳方法是向溶液中通入CO2;故答案为:
ZnO22-+2H+=Zn(OH)2↓;加入酸是为了使ZnO22-转化为Zn(OH)2沉淀,但加入酸不能过多,要防止发生Zn(OH)2+2H+=Zn2++2H2O,降低ZnO产量;CO2;
(3)根据上述分析步骤④目的是用双氧水氧化亚铁离子,反应的离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O;Fe3O4粒子中+2铁与+3价铁物质的量之比为1:
2,设Fe2+物质的量为x,则根据离子方程式分析所加H2O2的物质的量为:
,则应调整原溶液中Fe2+与所加H2O2的物质的量之比为x:
=3:
1,故答案为:
2Fe2++H2O2+2H+=2Fe3++2H2O;3:
1;
(4)防止Fe2+[或Fe(OH)2]被氧化,所以步骤⑤制得Fe3O4纳米粒子的过程,需要在无氧环境下进行;工业上通常通过持续通入N2提供无氧环境,故答案为:
防止Fe2+[或Fe(OH)2]被氧化;持续通入N2;
(5)根据加压抽滤的原理及纳米粒子半径大小分析,不能用抽滤的方法得到纳米Fe3O4粒子,原因是纳米粒子太小,抽滤时容易透过滤纸,故答案为:
不能;纳米粒子太小,抽滤时容易透过滤纸。
4.某淡黄色固体A(仅含三种元素,式量小于160)可用于制药,为探究其组成和性质,设计并完成如下实验:
已知:
①上述流程中所涉及的反应都充分进行。
②B、C、D均为常见气体。
相同情况下气体B的密度大气体C。
③黑色固体
溶于盐酸后滴加KSCN,无明显现象,加适量氯水后,溶液变红。
请问答:
(1)写出气体B的电子式__,固体A的化学式是__。
(2)黑色固体E与足量浓硝酸反应的离子反应方程式是__。
【答案】
FeC2O43FeO+10H++NO3-=NO+3Fe3++5H2O
【解析】
【分析】
B、C、D均为常见气体说明D单质为氧气,物质的量为
,相同情况下气体B的密度大气体C则说明B为二氧化碳,B与过氧化钠反应,则C为一氧化碳,气体物质的量为
由于生成0.1mol氧气,根据2CO2+2Na2O2=2Na2CO3+O2,因此二氧化碳的物质的量为0.2mol,CO物质的量为0.2mol,黑色固体E溶于盐酸后滴加KSCN,无明显现象,说明无铁离子,加适量氯水后,溶液变红,说明原物质为FeO,则m(FeO)=28.8g−0.2mol×28g∙mol−1−0.2mol×44g∙mol−1=14.4g,则FeO物质的量
,因此n(Fe):
n(C):
n(O)=0.2mol:
(0.2mol+0.2mol):
(0.2mol+0.2mol+0.2mol×2)=1:
2:
4,则化学式为FeC2O4。
【详解】
⑴气体B为二氧化碳,其电子式
,根据上面分析得到固体A的化学式是FeC2O4;故答案为:
;FeC2O4。
⑵黑色固体E即FeO与足量浓硝酸反应生成硝酸铁、一氧化氮和水,其离子反应方程式是3FeO+10H++NO3-=NO+3Fe3++5H2O;故答案为:
3FeO+10H++NO3-=NO+3Fe3++5H2O。
5.某工厂的工业硫酸盐废水中含有大量的Fe2+、Fe3+、较多的Cu2+和少量的Na+。
工厂计划从该废水中回收硫酸亚铁和金属铜,设计如下流程图。
回答下列问题;
(1)A的化学式为_________,D的化学式为_______。
(2)在工业废水中加入过量A时,发应的离子方程式有:
__________、______。
(3)得到FeSO4•7H2O晶体的操作Ⅲ为:
加热浓缩、冷却结晶、______、______、干燥。
【答案】FeH2SO4Fe+2Fe3+=3Fe2+Fe+Cu2+=Fe2++Cu过滤洗涤
【解析】
【分析】
工业废水中含大量Fe2+、Fe3+、Cu2+和少量的Na+,从该废水中回收硫酸亚铁和金属铜,结合流程可知,要加入铁粉,可置换出铜,同时生成硫酸亚铁,经过滤,得到的滤液C中主要含硫酸亚铁,滤渣B中含Cu、Fe,向该固体混合物中加入D为H2SO4,得到的溶液F为硫酸亚铁,得到滤渣E为Cu,将溶液C、F合并就是FeSO4溶液,溶液经蒸发、浓缩、冷却结晶、过滤,洗涤、干燥就可得到FeSO4·7H2O晶体,以此来解答。
【详解】
(1)加入铁粉,由于金属活动性Fe>Cu,可发生置换反应,置换出铜,反应的离子方程式为Fe+Cu2+=Fe2++Cu,铁、铜的混合物中加入稀硫酸,铁与稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式为Fe+2H+=Fe2++H2↑,所以A的化学式为Fe,D的化学式为H2SO4;
(2)由于离子的氧化性Fe3+>Cu2+>Fe2+>Na+,所以向工业废水中加入过量A时,首先发生反应Fe+2Fe3+=3Fe2+,然后发生反应Fe+Cu2+=Fe2++Cu;
(3)FeSO4的溶解度受温度的影响变化较大,所以从FeSO4的溶液中获得晶体经过加热,通过蒸发浓缩、冷却结晶,然后过滤、洗涤,最后干燥,就得到了FeSO4•7H2O晶体。
【点睛】
本题以废水处理流程为线索,考查了混合物的分离、提纯的操作过程、试剂的选用及离子方程式书写等,把握流程中发生的化学反应及分离方法为解答的关键,注重基础知识的考查。
6.已知有以下物质相互转化:
请回答下列问题:
(1)写出B的化学式___________,D的化学式为____________;
(2)写出由E转变成F的化学方程式________。
(3)写出D转化成H的离子方程式_________。
(4)除去溶液B中混有的少量G溶液的最适宜方法是________。
【答案】FeCl2KCl4Fe(OH)2+O2+2H2O=4Fe(OH)3Ag++Cl-=AgCl↓向溶液B中加入足量铁粉,再经过滤操作
【解析】
【分析】
D和硝酸银、稀硝酸的混合溶液反应生成沉淀H和焰色反应呈紫色的溶液可知,H为AgCl,D为KCl,白色沉淀E在空气中变成红褐色沉淀F可知E为Fe(OH)2,F为Fe(OH)3,所以G为FeCl3,A为Fe,B为FeCl2,C为NaOH,据此解答。
【详解】
(1)由分析可知,B为FeCl2,D为KCl,故答案为:
FeCl2;KCl;
(2)E为Fe(OH)2,F为Fe(OH)3,反应的方程式为:
4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:
4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)D为KCl,H为AgCl,D转化为H的离子方程式为:
Ag++Cl-=AgCl↓,故答案为:
Ag++Cl-=AgCl↓;
(4)FeCl2中混有的少量FeCl3,可用过量的铁粉将FeCl3转化为FeCl2,过量的铁粉用过滤除去,故答案为:
向溶液B中加入足量铁粉,再经过滤操作。
【点睛】
白色沉淀迅速变为灰绿色,最后变为红褐色所涉及的反应正是E到F:
4Fe(OH)2+2H2O+O2=4Fe(OH)3。
7.工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),流程如下:
(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为____________。
能提高烧渣浸取速率的措施有_________(填字母)。
A.将烧渣粉碎B.降低硫酸的浓度C.适当升高温度
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是___________(填字母)。
A.Fe粉B.SO2C.NaI
还原结束时,溶液中的主要阴离子有___________。
(3)滤渣Ⅱ主要成分的化学式为_____________;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是__________、__________过滤、洗涤、干燥。
【答案】4Fe2++O2+4H+=4Fe3++2H2OACBSO42-Al(OH)3蒸发浓缩冷却结晶
【解析】
【分析】
烧渣中加入稀硫酸,得到硫酸铁、硫酸亚铁和硫酸铝,二氧化硅不反应,过滤,滤渣Ⅰ为二氧化硅,在滤液中加入试剂X,随着X的加入,溶液pH逐渐减小,X应为SO2,得到硫酸铝和硫酸亚铁溶液,调节溶液pH,生成氢氧化铝沉淀,滤渣Ⅱ为氢氧化铝,溶液经蒸发结晶、过滤、洗涤、干燥,可得到FeSO4•7H2O。
【详解】
(1)溶液中的Fe2+易被空气中的O2氧化,反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,提高烧渣浸取速率,可增大固体的表面积,提高反应温度,或增大离子的浓度的方法,所以选项AC正确;
(2)由以上分析可知,随着X的加入,溶液酸性增强,应通入二氧化硫,被氧化生成硫酸,反应后溶液中含有SO42-;
(3)由以上分析可知滤渣Ⅱ为氢氧化铝,即Al(OH)3,溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥,可得到FeSO4•7H2O。
8.钼酸钠晶体(Na2MoO4·2H2O)是一种金属腐蚀抑制剂。
工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示。
(1)NaClO的电子式为___。
(2)途径Ⅰ碱浸时发生反应的化学方程式为____。
(3)途径Ⅱ氧化时还有Na2SO4生成,则反应的离子方程式为____。
(4)已知途径Ⅰ的钼酸钠溶液中c(MoO42-)=0.40mol/L,c(CO32-)=0.10mol/L。
由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去CO32-。
当BaMoO4开始沉淀时,CO32-的去除率是______[已知Ksp(BaCO3)=1×10-9、Ksp(BaMoO4)=4.0×10-8,忽略溶液的体积变化]。
(5)分析纯钼酸钠常用钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径Ⅰ所产生的气体一起通入水中,得到正盐的化学式是_______。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。
常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如图
①当硫酸的浓度大于90%时,碳素钢腐蚀速率几乎为零,原因是____。
②若缓蚀剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1,则缓蚀效果最好时钼酸钠(M=206g·mol-1)的物质的量浓度为____(计算结果保留3位有效数字)。
【答案】
MoO3+Na2CO3=Na2MoO4+CO2↑MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O90%(NH4)2CO3和(NH4)2SO3常温下浓硫酸会使铁钝化7.28×10-4mol/L
【解析】
【分析】
根据流程利用钼精矿(主要成分是MoS2)制备钼酸钠有两种途径:
途径Ⅰ是先在空气中灼烧生成MnO3,得到对环境有污染的气体SO2,用碱液可以吸收,然后再用纯碱溶液溶解MnO3,发生反应:
MoO3+Na2CO3═Na2MoO4+CO2↑,得到钼酸钠溶液,最后结晶得到钼酸钠晶体;途径Ⅱ是直接用NaClO溶液在碱性条件下氧化钼精矿得到钼酸钠溶液,反应为MnS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O,结晶后得到钼酸钠晶体,据此分析作答。
【详解】
(1)离子化合物NaClO的电子式为
;
(2)途径I碱浸时MoO3和纯碱溶液反应生成钼酸钠,同时得到CO2气体,反应方程式为MoO3+Na2CO3=Na2MoO4+CO2↑;
(3)途径II氧化时还有Na2SO4生成,反应物NaClO在碱性条件下氧化MoS2,得到钼酸钠和NaCl、硫酸钠和水,本质为次氯酸根离子氧化MoS2中钼和硫,化合价变化为:
升高Mo(+2→+6),S(-1→+6),降低Cl(+1→-1),最小公倍数18,发生反应的离子方程式为:
MoS2+9ClO-+6OH-=MoO42-+9Cl-+2SO42-+3H2O;
(4)Ksp(BaMoO4)=4.0×10-8,钼酸钠溶液中c(MoO42-)=0.40mol•L-1,BaMoO4开始沉淀时,溶液中钡离子的浓度为:
c(Ba2+)=
,Ksp(BaCO3)=1×10-9,溶液中碳酸根离子的浓度为:
c(CO32-)=
mol/L=0.01mol/L,则碳酸根的去除率为
=90%;
(5)四钼酸铵[(NH4)2MoO4]和氢氧化钠反应可生成NH3,途径Ⅰ中生成的气体有CO2和SO2,将NH3和CO2或SO2一起通入水中可生成正盐为(NH4)2CO3和(NH4)2SO3;
(6)①当硫酸的浓度大于90%时,可以认为是浓硫酸,碳素钢的主要成分含有铁,常温下浓硫酸具有强氧化性,会使铁钝化,表面生成致密的氧化膜,起到防腐蚀作用,所以其腐蚀速率几乎为零;
②缓蚀剂钼酸钠-月桂酸肌氨酸总浓度为300mg·L-1,据图可知缓蚀效果最好时钼酸钠和月桂酸肌氨酸的浓度均为150mg/L,则1L钼酸钠溶液中钼酸钠的物质的量为
,所以物质的量浓度为7.28×10-4mol/L。
9.闪锌精矿(含有ZnS、SiO2和少量FeS杂质),钛白废液(含H2SO4约20%,还有少量Fe2+、TiO2+)。
利用钛白废液及闪锌精矿联合生产七水合硫酸锌流程简化如下:
回答下列问题:
(1)在焙烧过程中,产生了具有漂白性的气体和金属氧化物,其中气体是_________,滤渣X的主要成分是_________________。
(2)氧化时,如果鼓入空气不足,其弊端是__________,生成H2TiO3的相关离子反应方程式为____________,从生产实际考虑,调pH时,选择加入石灰乳而不是烧碱的原因是_________。
(3)常温下,滤液Y中锌离子浓度约为6mol/L,若Ksp[Fe(OH)3]=4.0×10-38,Ksp[Zn(OH)2]=6.0×10-18。
据此分析,加入石灰乳调节的pH应不超过________,此时溶液中还有的杂质阳离子为H+和__________。
(4)工业上,常用电解硫酸四氨合锌(II)溶液(含[Zn(NH3)4]2+)制备单质锌,其阴极的电极反应式为__________。
【答案】SO2(或二氧化硫)SiO2(或二氧化硅)Fe2+氧化