第二节 化学计量在实验中的应用2教师版.docx
《第二节 化学计量在实验中的应用2教师版.docx》由会员分享,可在线阅读,更多相关《第二节 化学计量在实验中的应用2教师版.docx(11页珍藏版)》请在冰豆网上搜索。
第二节化学计量在实验中的应用2教师版
二、气体摩尔体积
1、物质的体积与微观粒子的关系
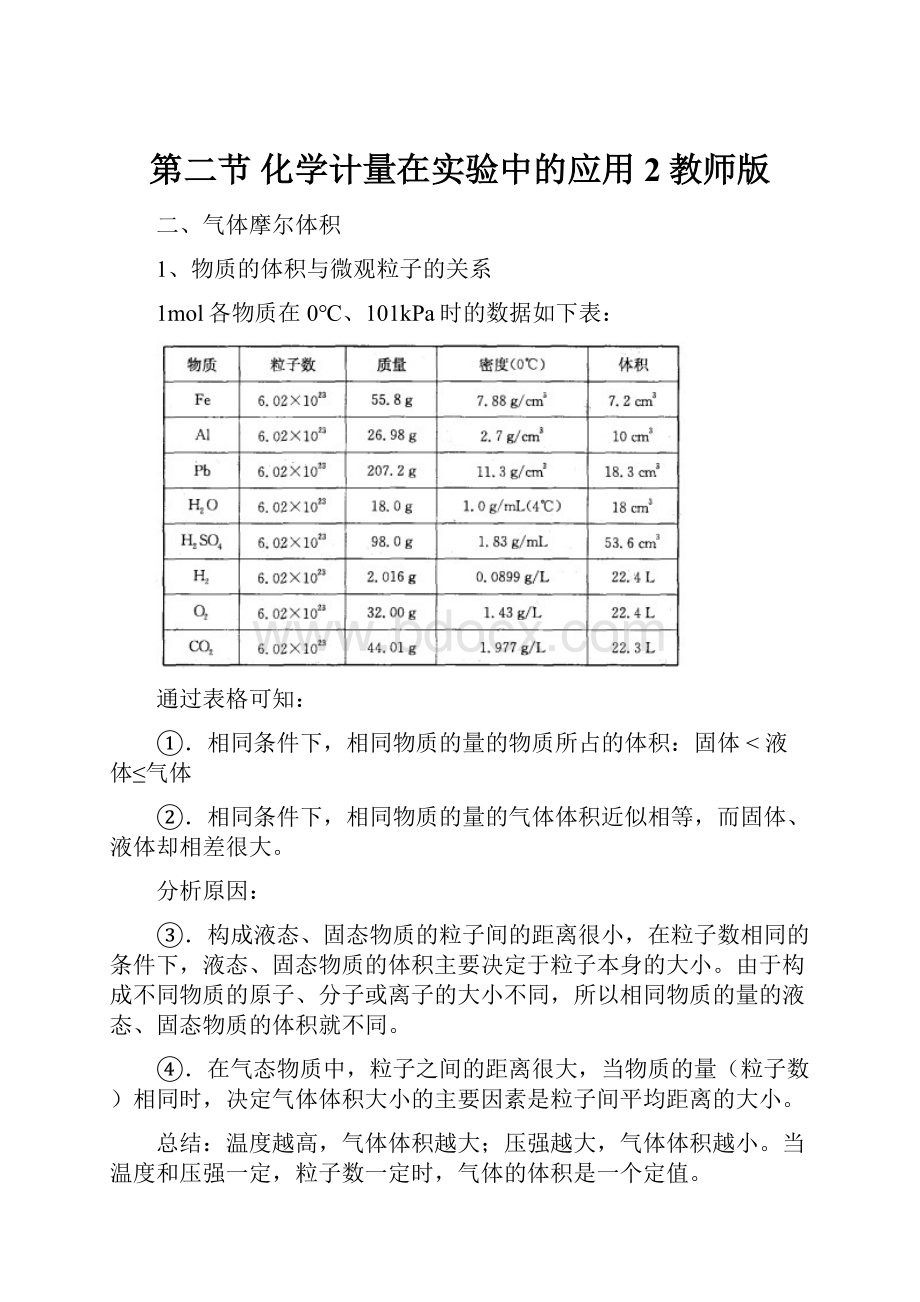
1mol各物质在0℃、101kPa时的数据如下表:
通过表格可知:
①.相同条件下,相同物质的量的物质所占的体积:
固体<液体≤气体
②.相同条件下,相同物质的量的气体体积近似相等,而固体、液体却相差很大。
分析原因:
③.构成液态、固态物质的粒子间的距离很小,在粒子数相同的条件下,液态、固态物质的体积主要决定于粒子本身的大小。
由于构成不同物质的原子、分子或离子的大小不同,所以相同物质的量的液态、固态物质的体积就不同。
④.在气态物质中,粒子之间的距离很大,当物质的量(粒子数)相同时,决定气体体积大小的主要因素是粒子间平均距离的大小。
总结:
温度越高,气体体积越大;压强越大,气体体积越小。
当温度和压强一定,粒子数一定时,气体的体积是一个定值。
2、气体摩尔体积
①、定义:
单位物质的量的气体所占的体积叫做气体摩尔体积。
②、符号:
Vm
③、单位:
L/mol或m3/mol
④、定义式:
Vm=V/n(n=V/Vm)
其中V----气体体积,L或m3;
n----物质的量,mol。
⑤、特例:
在标准状况下(0℃、101kPa)下,Vm≈22.4L/mol,即在标准状况下,1mol任何气体的体积都约为22.4L。
⑥、注意:
使用气体摩尔体积的要素
A、状态:
必须是气态物质(可以是混合气体),但要特别注意,经常以气态形式出现但在标准状况下是液态或固态的物质,如SO3(标态下为固态)和H2O(标态下为液态)。
B、条件:
只有在标准状况下,Vm≈22.4L/mol,不是标准状况的前提条件下,若温度和压强一定,1mol任何气体的体积都是一个定值,不一定是22.4L。
C、定量:
Vm≈22.4L/mol是1mol任何气体在标准状况下的体积,若气体不是1mol,则其体积也不是22.4L,而是22.4L/mol×nmol=22.4nL。
3、阿伏加德罗定律
①、内容:
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子。
②、适用范围:
阿伏加德罗定律只适用于气体,不适用于固体和液体。
阿伏加德罗定律对于混合气体也适用,如相同的状况下1L空气和1L氧气所含的分子数相同。
③、“三同定一同”:
同温同压同体积的气体分子数一定相同。
4、平均摩尔质量及其求算方法
①、平均摩尔质量(
):
假设混合气体为1mol,组成1mol混合气体的每一种气体的摩尔质量与其所占的体积的乘积之和,以g/mol为单位,就是混合气体的平均摩尔质量。
注意:
平均摩尔质量不仅适用于气体,对固体和液体也同样适用,常用于混合物的计算。
②、平均摩尔质量的求算方法
3、平均值规律:
某元素的质量分数总是介于组分的相应量的最大值与最小值之间。
4、物质的质量、物质的量、气体体积、粒子数之间的转换关系